Бензол октановое число — Справочник химика 21
Для расчетов соотношения бензинов, необходимых для смешения, с некоторым приближением можно принять, что октановое число смеси является средним арифметическим между октановыми числами бензинов, взятых для смешения. При добавлении в бензины бензола необходимо помнить, что октановое число смешения у бензола ниже, чем в чистом виде. [c.332]Из данных табл. 25 видно, что при добавлении бензола октановые числа смесей значительно ниже тех, которые можно было бы ожидать по расчету. Например, смесь, состоящая из 10% бензола и 90% бензина, характеризуется октановым числом 71, вместо 74, ожидаемого исходя из аддитивности. Октановое число смешения бензола в этой смеси оказалось равным 80, тогда как в чистом виде оно равно 106. Октановые числа смешения изопентана и изооктана близки к их октановым числам в чистом виде. Необходимо отметить, что октано- [c.117]
Октановые числа смешения газовых бензинов, бензинов прямой перегонки из парафинистого и смешанного сырья некоторых технически чистых углеводородов изостроения обычно близки к их октановым числам в чистом виде. Бензиновые фракции каталитических процессов и продукты алкилирования, полимеризации и изомеризации имеют октановые числа смешения несколько выше, чем в чистом виде. Октановые числа смешения бензола, толуола и ксилолов ниже, чем их октановые числа в чистом виде. Алки-лированные бензолы с разветвленной боковой цепью имеют октановые числа смешения более высокие, чем в чистом виде. Октановое число смешения высокооктанового компонента обычно тем выше, чем ниже октановое число базового топлива.
Все эти простейшие ароматические углеводороды — бензол, толуол и ксилолы — повышают октановое число бензина. Содержащий их бензин иногда называют аро- [c.59]
Для облегчения расчетов обычно выбирают наиболее значимые эксплуатационные показатели качества и наиболее массовые (т.е. высокотаннажные), так называемые базовые компоненты топлива. Для высокооктановых автобензинов в качестве наиболее значимых показателей качества принято считать детонационную стойкость и испаряемость, а в качестве базовых компонентов — бензиновые фракции многотоннажных процессов прямой перегонки, каталитического риформинга, каталитического крекинга, гидрокрекинга, реже термодеструктивных процессов. Для улучшения тех или иных характеристик смеси бензиновых компонентов применяют высокооктановые компоненты-добавки, такие, как алкилаты, изомеризаты, эфиры, и низкокипящие углеводороды бутановую, изобутановую, изопента-новую, пентан-амиленовую фракции, газовый бензин, бензол, толуол и т.д., а также этиловую жидкость и присадки. Детонационная стойкость является часто решающим показателем, определяющим компактный состав товарных высокооктановых автобенэинов. Требуемая высокая детонационная стойкость достигается, во-первых, использованием наиболее высокооктановых базовых бензинов и увеличением их доли в компонентном составе автобензина, во-вторых, добавлением высокооктановых компонентов и, в-третьих, применением антидетона-ционных присадок в допустимых пределах. При разработке рецептуры товарных высокооктановых автобенэинов следует оперировать октановыми числами не чистых компонентов, а смесительной их характеристикой, т.е. октановыми числами смешения стремиться обеспечить равномерность распределения детонационной стойкости по фракциям и, хотя это не предусмотрено в современных ГОСТ, желательно, чтобы содержание ароматических углеводородов составляло не более 45 -50% и бензола — не более 6%. Для удовлетворения требований по их испаряемости, т.е. по фракционному составу и давлению насыщенных паров, в базовые компоненты, как правило, вводят низкокипящие компоненты. Выбор базовых высокооктановых и низкокипящих
Октановое число смешения. Современныетоварныеавтобензи — ны готовят, как правило, смешением (компаундированием) компонен — тов, получаемых в различных процессах нефтепереработки, различающихся физическим и химическим составом. Установлено, что ДС смеси компонентов не является аддитивным свойством. Октановое число компонента в смеси может отличаться от этого показателя в чистом виде. Каждый компонент имеет свою смесительную характеристику или, как принято называть, октановое число смешения (04С). (34С парафиновых углеводородов как нормального, так и изостроения близки к их 04 в чистом виде. ОЧС ароматических углеводородов, как правило, ниже, чем 04 их в чистом виде эта разница достигает до 30 и более. Например, бензол, имеющий в чистом виде 04 113 единиц, при [c.108]
Вторичная перегонка бензинового дистиллята, представляет собой либо самостоятельный процесс, либо является частью комбинированной установки, входящей в состав нефтеперерабатывающего завода. На современных заводах установки вторичной перегонки бензинового дистиллята предназначены для получения из него узких фракций. Эти фракции используют в дальнейшем как сырье каталитического риформинга — процесса, в результате которого получают индивидуальные ароматические углеводороды — бензол, толуол, ксилолы, либо бензин с более высоким октановым числом. При производстве ароматических углеводородов исходный бензиновый дистиллят разделяют на фракции с температурами выкипания 62—85 С (бензольную), 85—115 (120) °С (толуольную) и 115 (120)—140 С (ксилольную).
Так, каталитическим крекингом получают дополнительные количества высокооктановых бензинов, посредством каталитического риформинга повышают октановое число бензинов и получают ароматические углеводороды (бензол, толуол, ксилолы и этилбензол). Гидроочистка позволяет производить реактивные и дизельные топлива с малым содержанием серы. Процесс пиролиза дает возможность получить из нефти важнейшее сырье для нефтехимии этилен, пропилен, бутилены и моноциклические ароматические углеводороды, а также сырье для производства высококачественных сажи и электродного кокса. [c.198]
На рис. 12 показано влияние углеводородного состава сырья и начала его кипения на выход бензина с октановым числом 95 [4]. При каталитическом риформинге можно также получать индивидуальные ароматические углеводороды бензол, толуол, этилбензол и изомеры ксилола. В этом случае сырьем процесса являются более узкие фракции,- выкипающие в зависимости от целевого продукта в пределах 62—105°С (или 62—120°С), 105—140°С (или 120—140 °С). [c.40]
Высокооктановые ко
Бензин. Октановое число. Способы повышения октанового числа
Тема: Предельные углеводороды
Урок: Бензин. Октановое число
Способы повышения октанового числа
Потребительские свойства бензина в первую очередь определяются его стойкостью к детонации в двигателе внутреннего сгорания.
Чтобы понять, что такое детонация в двигателе, рассмотрим работу стандартного четырехтактного двигателя внутреннего сгорания.
В первом такте в цилиндр впускается смесь паров бензина и воздуха, во втором такте эта смесь сжимается поршнем. В третьем такте искра от свечи зажигания воспламеняет смесь; при сгорании происходит расширение газов и совершается полезная работа. В четвертом такте из цилиндра выбрасываются отработанные газы – продукты сгорания. Рис. 1.
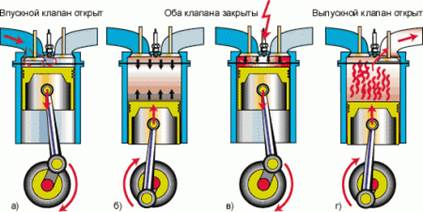
Рис. 1. Работа четырехтактного двигателя внутреннего сгорания
Вся полезная работа совершается в третьем такте, и именно он сильнее всего зависит от качества бензина. Чем сильнее сжата смесь перед воспламенением, тем выше КПД двигателя. Очень важно, чтобы воспламенение бензиново-воздушной смеси происходило строго в нужный момент, поскольку движения поршня и работа клапанов впуска-выпуска сопряжены друг с другом с высокой точностью.
Из физики известно, что при сжатии газа происходит его разогрев. Поэтому в цилиндре двигателя возможна вспышка бензиново-воздушной смеси без искры, только за счет сжатия. Но гораздо хуже то, что при такой самопроизвольной вспышке во всем объеме обычно происходит не быстрое равномерное сгорание, а детонация – взрыв смеси. Скорость горения при переходе к детонации увеличивается с 15–20 м/с до 1500–2500 м/с. Детали при этом работают несогласованно и могут разрушиться от чрезмерных нагрузок.
Органические соединения, входящие в состав бензина, должны быть устойчивы к преждевременному воспламенению и детонации. Эта устойчивость характеризуется октановым числом бензина.
Шкала октановых чисел основана на двух алканах: н-гептане (tкип. 98,50) Рис. 2. и 2,2,4-триметилпентане (изооктане) (tкип. 99,20) Рис. 3.
У этих алканов почти одинаковые температуры кипения, но разное строение. Разветвленный изооктан гораздо более устойчив к детонации, чем «линейный» гептан.
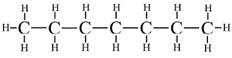
Рис. 2. н — гептан(tкип. 98,5 0С)

Рис. 3. Изооктан ( 2,2,4 триметилпентан) tкип. 99,20 С
Для н-гептана принято октановое число 0, а для изооктана – 100. Бензины сравнивают по устойчивости к детонации со смесью н-гептана и изооктана.
В России продаваемые на заправках бензины имеют октановые числа АИ-80, АИ-92,
АИ-95 и АИ-98. Октановое число типа АИ определяют на специальном исследовательском двигателе с переменной степенью сжатия в режиме малых и средних нагрузок. Испытываемый бензин сравнивают со стандартной смесью н-гептана и изооктана и присваивают бензину октановое число, соответствующее содержанию изооктана в стандартной смеси. Например, бензин АИ-92 соответствует по детонации при малых и средних нагрузках смеси из 92% изооктана и 8% н-гептана.
Различные органические соединения обладают разной устойчивостью к детонации в двигателе, при этом нет прямой связи между строением вещества и его октановым числом.
Табл. 1. Значения октанового числа различных видов топлива.
|
Вещество |
Октановое число |
|
Метан |
107,5 |
|
Пропан |
105,7 |
|
Бутан |
93,6 |
|
Пентан |
|
|
н-гептан |
0 |
|
Изооктан (2,2,4-триметилпентан) |
100 |
|
Бензол |
113,0 |
|
Бензины прямой перегонки |
43–58 |
|
Бензины каталитического крекинга |
80–85 |
|
Бензины каталитического риформинга |
83–97 |
|
Бензин АИ-92 |
92 |
|
Этанол |
105 |
|
Метил-третбутиловый эфир |
117 |
Из таблицы 1 видно, что при обычной перегонке нефти невозможно получить бензин для современных двигателей – октановое число бензина прямой перегонки не превышает 60. Поэтому нефть подвергают специальной переработке в присутствии катализаторов.
При каталитическом крекинге нефть или ее тяжелые фракции нагревают до 510–5400С на катализаторе – шариках алюмосиликатов (цеолитах). Молярная масса исходных алканов уменьшается, из них получаются алкены и ароматические углеводороды. При этом удается превратить исходное сырье в бензин с выходом до 60%. Октановое число бензина каталитического крекинга – 91–92. В бензинах, полученных каталитическим крекингом, велика доля ароматических углеводородов, а также алкенов. Последние со временем полимеризуются, поэтому такой бензин не может долго храниться.
При каталитическом риформинге бензины прямой перегонки нагревают до 480–5200С при повышенном до 35 атм давлении на катализаторе – оксиде алюминия с добавками платины, рения и других металлов. При риформинге происходит образование ароматических углеводородов из циклоалканов. Исходное сырье превращается в бензин АИ-95 с выходом до 74%.
Кроме каталитических процессов для получения высокооктановых бензинов используют специальные добавки.
Самая эффективная из таких добавок – тетраэтилсвинец Pb(C2H5)4. Однако он очень ядовит, к тому же отравляет специальные каталитические дожигатели топлива, очищающие автомобильные выхлопные газы.
Наименее вредная добавка к бензину – метилтретбутиловый эфир СН3—O—C(СН3)3, имеющий октановое число 117. Этот эфир широко применяется в Европе и в России. Однако его доля в бензине велика (5–12%), и требуется массовое производство данного продукта.
Перспективным считается использование в качестве моторного топлива этилового спирта (октановое число 105), однако он пока дороже бензина.
Подведение итога урока
На уроке была рассмотрена тема: «Бензин. Октановое число. Способы повышения октанового числа». Вы узнали о самых востребованных продуктах переработки нефти – моторных топливах, о том, что представляет собой бензин и его октановое число, а также о существующих способах повышения октанового числа.
Список литературы
1. Рудзитис Г.Е. Химия. Основы общей химии. 10 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф.Г. Фельдман. – 14-е издание. – М.: Просвещение, 2012.
2. Химия. 10 класс. Профильный уровень: учеб. для общеобразоват. учреждений/ В.В. Еремин, Н.Е. Кузьменко, В.В. Лунин и др. – М.: Дрофа, 2008. – 463 с.
3. Химия. 11 класс. Профильный уровень: учеб. для общеобразоват. учреждений/ В.В. Еремин, Н.Е. Кузьменко, В.В. Лунин и др. – М.: Дрофа, 2010. – 462 с.
4. Хомченко Г.П., Хомченко И.Г. Сборник задач по химии для поступающих в вузы. – 4-е изд. – М.: РИА «Новая волна»: Издатель Умеренков, 2012. – 278 с.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
1. Interneturok.ru (Источник).
2. Органическая химия (Источник).
3. Химик (Источник).
Домашнее задание
1. №№ 15–17 (с. 75) Рудзитис Г.Е., Фельдман Ф.Г. Химия: Органическая химия. 10 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г. Е. Рудзитис, Ф.Г. Фельдман. – 14-е издание. – М.: Просвещение, 2012.
2. Что такое октановое число?
3. Для чего применяется метод добавок? В чем его преимущества и недостатки?
Эксплуатационные характеристики нефти и нефтепродуктов. Октановое число.
Карта сайта- Разработки
- Добавка БТ (МИНИМА)
- Монометиланилин (ММА)
- Производство ММА
- ММА на НПЗ
- Метаформинг
- Результаты испытаний
- Исходный бензин
- Испытание 1
- Испытание 2
- Физ/Хим показатели
- Инструкции
- Применение МИНИМА
- Разработка присадок
- Ферроцен
- Очиститель инжектора
- Бензин спортивный
- ЦГН
- Бензины ЕВРО-3, ЕВРО-4
- Справочник
- Антидетонаторы
- ТЭС
- Железосодержащие
- Марганецсодержащие
- Оксигенаты
- Ароматические амины
- Допущенные присадки
- ГОСТы
- ГОСТ 2084-77
- ГОСТ Р 51105-97
- ГОСТ Р 51313-99
- ГОСТ Р 51866-2002
- Технический регламент
- Топливная хартия
- Сортность бензина
- Перв. переработка нефти
- Обессоливание
- Атм. и вакуумн. перегонка
- Вторичная перегонка
- Газофракционирование
- Процессы пр-ва бензинов
- Каталитический риформинг
- Изомеризация
- Гидроочистка
- Каталитический крекинг
- Алкилирование
- Олигомеризация олефинов
- Гидрокрекинг
- Висбрекинг
- Коксование
- Технологии пр-ва масел
- Производство масел
- Деасфальтизация гудрона
- Очистка растворителями
- Депарафинизация масел
- Контактная доочистка
- Гидродоочистка масел
- Технол. пр-ва парафинов
- Производство парафинов
- Неочищенные парафины
- Доочистка парафинов
- Жидкие парафины
- Производство битумов
- Методы испытаний
- КМКО
- Испаряемость
- Потери от Испарения
- Защитные свойства
- Оборудование НПЗ
- Реакторное оборудование
- Технологические печи
- Ректифик. колонны
- Теплообменные аппараты
- Вакуум. устройства
- Насосы
- Компрессоры
- Емкости, резервуары
- Трубопроводы
- Констр. материалы
- Физ-химия нефти
- Плотность
- Молекулярная масса
- Вязкость
- Поверхностное натяжение
- Характеризующий фактор
- Давление насыщ. паров
- Конст. фазов. равновесия
- Критические параметры
- Теплоемкость
- Теплота испарения
- Теплота плавления
- Теплотворная способность
- Энтальпия
- Теплопроводность
- Тепловые эффекты
- Индивид. соединения
- Хар-ки нефтепродуктов
- Фракционный состав
- Температура застывания
- Октановое число
- Цетановое число
- Высота нек. пламени
- Методы испытаний
- Сырье НПЗ
- Классификация нефтей
- Характеристика нефтей
- Газовые конденсаты
- Топлива
- Нефтяные масла
- Присадки к маслам
- Ароматика
- Сжиженные газы
- Др. нефтепродукты
- Общезав. хоз-во НПЗ
- Прием и отгрузка
- Хранение нефтепродуктов
- Электроснабжение
- Теплоснабжение
- Водоснабжение
- Канализация, очистка
- Снабжение топливом
- Снабжение газами
- Факела
- Пром. безопасность
- Свойства продуктов
- Категорирование
- Электрооборудование
- Трубопроводы
- Охрана окруж. среды
- Основные понятия
- Нормирование
- Контроль
- Антидетонаторы
- Статьи
- Проектирование
- Консультации
- Моделирование
- Оборудование
- Каталог
- Теплообменники
- Емкости
- Нестандарт. оборудование
- Колонные аппараты
- Реакторное оборудование
- Установка риформинга
- Сертификация
- Утилизация
- Статический смеситель
- Описание
- Опросной лист
- Динамический смеситель
- Регенерация масел
- мини НПЗ
- Химизм риформинга
- Реакции риформинга
- Влияние параметров
- Для хим.лаборатории
- Химреактивы
- ГС
Бензол — Википедия
| Бензол | |||
|---|---|---|---|
{{{картинка3D2}}}) ( ({{{картинка малая}}}) | |||
| Систематическое наименование | бензол | ||
| Сокращения | PhH | ||
| Традиционные названия | фен (Лоран, 1837), фениловый водород, бензен | ||
| Хим. формула | C6H6 | ||
| Рац. формула | C6H6 | ||
| Состояние | жидкость | ||
| Молярная масса | 78,11 г/моль | ||
| Плотность | 0,8786 г/см³ | ||
| Динамическая вязкость | 0,0652 Па·с | ||
| Энергия ионизации | 9,24 ± 0,01 эВ[2] | ||
| Температура | |||
| • плавления | 5,5 °C | ||
| • кипения | 80,1 °C | ||
| • вспышки | −11 °C | ||
| • самовоспламенения | 562 °C | ||
| Пределы взрываемости | 1,2 ± 0,1 об.%[2] | ||
| Энтальпия | |||
| • образования | 82 930 Дж/моль[1] и 49 080 Дж/моль[1] | ||
| Давление пара | 75 ± 1 мм рт.ст.[2] | ||
| Растворимость | |||
| • в воде | 0,073 г/100 мл | ||
| Рег. номер CAS | 71-43-2 | ||
| PubChem | 241 | ||
| Рег. номер EINECS | 200-753-7 | ||
| SMILES | |||
| InChI | |||
| RTECS | CY1400000 | ||
| ChEBI | 16716 | ||
| ChemSpider | 236 | ||
| Токсичность | токсичен, обладает канцерогенными и наркотическими свойствами | ||
| Краткие характер. опасности (H) | h325, h404, h415, h419, h440, h450, h472, h512 | ||
| Меры предостор. (P) | P201, P210, P280, P308+P313, P370+P378, P403+P235 | ||
| Сигнальное слово | ОПАСНО! | ||
| Пиктограммы СГС |       | ||
| NFPA 704 |  | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |||
Бензо́л (C6H6, PhH) — органическое химическое соединение, бесцветная жидкость со специфическим сладковатым запахом. Простейший ароматический углеводород. Бензол входит в состав бензина, широко применяется в промышленности, является исходным сырьём для производства лекарств, различных пластмасс, синтетической резины, красителей. Хотя бензол входит в состав сырой нефти, в промышленных масштабах он синтезируется из других её компонентов. Токсичен, канцерогенен. Контаминант.
Впервые бензолсодержащие смеси, образующиеся в результате перегонки каменноугольной смолы, описал немецкий химик Иоганн Глаубер в книге Furni novi philosophici, опубликованной в 1651 году[3]. Бензол как индивидуальное вещество был описан Майклом Фарадеем, выделившим это вещество в 1825 году из конденсата светильного газа, получаемого коксованием угля. Вскоре, в 1833 году, получил бензол — при сухой перегонке кальциевой соли бензойной кислоты — и немецкий физико-химик Эйльгард Мичерлих. Именно после этого получения вещество стали называть бензолом.
К 1860-м годам было известно, что соотношение количества атомов углерода и атомов водорода в молекуле бензола аналогично таковому у ацетилена, и эмпирическая формула их — CnHn. Изучением бензола серьёзно занялся немецкий химик Фридрих Август Кекуле, которому в 1865 году и удалось предложить правильную — циклическую формулу этого соединения. Известна история о том, что Ф. Кекуле представлял в своём воображении бензол в виде змеи из шести атомов углерода[4]. Идея же о цикличности соединения пришла ему во сне, когда воображаемая змея укусила себя за хвост. Фридриху Кекуле удалось в то время наиболее полно описать свойства бензола.
Бензол (жидкий)Бесцветная жидкость со своеобразным резким запахом. Температура плавления = 5,5 °C, температура кипения = 80,1 °C, плотность = 0,879 г/см³, молярная масса = 78,11 г/моль. Подобно ненасыщенным углеводородам бензол горит сильно коптящим пламенем. С воздухом образует взрывоопасные смеси, хорошо смешивается с эфиром, бензином и другими органическими растворителями, с водой образует азеотропную смесь с температурой кипения 69,25 °C (91 % бензола). Растворимость в воде 1,79 г/л (при 25 °C).
Для бензола характерны реакции замещения — бензол реагирует с алкенами, хлоралканами, галогенами, азотной и серной кислотами. Реакции разрыва бензольного кольца проходят в жёстких условиях (температура, давление).
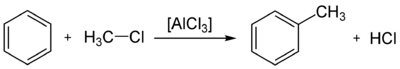
- Взаимодействие с алкенами (алкилирование), в результате реакции образуются гомологи бензола, например, этилбензол и кумол:
- C6H6+h3C=Ch3→AlCl3∗HClC6H5Ch3Ch4{\displaystyle {\mathsf {C_{6}H_{6}+H_{2}C=CH_{2}{\xrightarrow[{}]{AlCl_{3}*HCl}}C_{6}H_{5}CH_{2}CH_{3}}}}
- C6H6+Ch3=CH−Ch4→AlCl3∗HClC6H5CH(Ch4)2{\displaystyle {\mathsf {C_{6}H_{6}+CH_{2}=CH-CH_{3}{\xrightarrow[{}]{AlCl_{3}*HCl}}C_{6}H_{5}CH(CH_{3})_{2}}}}
- C6H6+Cl2→FeCl3C6H5Cl+HCl{\displaystyle {\mathsf {C_{6}H_{6}+Cl_{2}{\xrightarrow[{}]{FeCl_{3}}}C_{6}H_{5}Cl+HCl}}}
- В отсутствие катализатора при нагревании или освещении идёт радикальная реакция присоединения с образованием смеси изомеров гексахлорциклогексана
- C6H6+3Cl2→T,hνC6H6Cl6{\displaystyle {\mathsf {C_{6}H_{6}+3Cl_{2}{\xrightarrow[{}]{T,h\nu }}C_{6}H_{6}Cl_{6}}}}
- При взаимодействии бензола с бромом в растворе олеума образуется гексабромбензол:
- C6H6+6Br2→h3SO4∗SO3C6Br6+6HBr{\displaystyle {\mathsf {C_{6}H_{6}+6Br_{2}{\xrightarrow[{}]{H_{2}SO_{4}*SO_{3}}}C_{6}Br_{6}+6HBr}}}
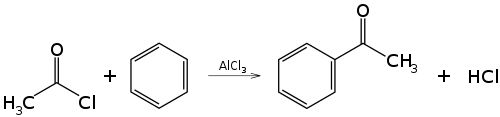
- Реакция ацилирования по Фриделю—Крафтсу, бензола ангидридами, галогенангидридами карбоновых кислот приводит к образованию ароматических и жирноароматических кетонов:
- C6H6+(Ch4CO)2O→AlCl3C6H5COCh4+Ch4COOH{\displaystyle {\mathsf {C_{6}H_{6}+(CH_{3}CO)_{2}O{\xrightarrow[{}]{AlCl_{3}}}C_{6}H_{5}COCH_{3}+CH_{3}COOH}}}
- C6H6+C6H5COCl→AlCl3C6H5COC6H5+HCl{\displaystyle {\mathsf {C_{6}H_{6}+C_{6}H_{5}COCl{\xrightarrow[{}]{AlCl_{3}}}C_{6}H_{5}COC_{6}H_{5}+HCl}}}
В первой и второй реакциях образуется ацетофенон (метилфенилкетон), замена хлорида алюминия на хлорид сурьмы V позволяет снизить температуру протекании реакции до 25° С. В третьей реакции образуется бензофенон (дифенилкетон).
- Реакция формилирования — взаимодействие бензола со смесью СО и НСl, протекает при высоком давлении и под действием катализатора, продуктом реакции является бензальдегид:
- C6H6+CO+HCl→AlCl3C6H5COH+HCl{\displaystyle {\mathsf {C_{6}H_{6}+CO+HCl{\xrightarrow[{}]{AlCl_{3}}}C_{6}H_{5}COH+HCl}}}
- Реакции сульфирования и нитрования (электрофильное замещение):
- C6H6+HNO3→h3SO4C6H5NO2+h3O{\displaystyle {\mathsf {C_{6}H_{6}+HNO_{3}{\xrightarrow[{}]{H_{2}SO_{4}}}C_{6}H_{5}NO_{2}+H_{2}O}}}
- C6H6+h3SO4→C6H5SO3H+h3O{\displaystyle {\mathsf {C_{6}H_{6}+H_{2}SO_{4}\rightarrow C_{6}H_{5}SO_{3}H+H_{2}O}}}
- Восстановление бензола водородом (каталитическое гидрирование):
- C6H6+3h3→Ni/Pd,Pt;tC6h22{\displaystyle {\mathsf {C_{6}H_{6}+3H_{2}{\xrightarrow[{}]{Ni/Pd,Pt;t}}C_{6}H_{12}}}}
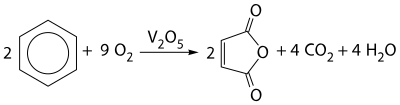
Реакции окисления[править | править код]
Бензол, вследствие своего строения, очень устойчив к окислению, на него не действует, например, раствор перманганата калия. Однако окисление до малеинового ангидрида можно провести при помощи катализатора оксида ванадия V:
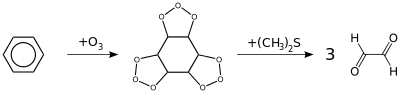
- Реакция озонолиза. Также бензол подвергается озонолизу, но процесс протекает медленнее, чем с непредельными углеводородами:
Результатом реакции является образование диальдегида — глиоксаля (1,2-этандиаля).
- Реакция горения. Горение бензола является предельным случаем окисления. Бензол легко воспламеняется и горит на воздухе сильно коптящим пламенем (содержит до 92% углерода в молекуле):
- 2C6H6+15O2→12CO2+6h3O{\displaystyle {\mathsf {2C_{6}H_{6}+15O_{2}\rightarrow 12CO_{2}+6H_{2}O}}}
Бензол по составу относится к ненасыщенным углеводородам (гомологический ряд CnH2n−6), но в отличие от углеводородов ряда этилена, C2H4, проявляет свойства, присущие ненасыщенным углеводородам (для них характерны реакции присоединения), только при жёстких условиях, а вот к реакциям замещения бензол более склонен. Такое «поведение» бензола объясняется его особым строением: нахождением атомов в одной плоскости и наличием в структуре сопряжённого 6π-электронного облака. Современное представление об электронной природе связей в бензоле основывается на гипотезе Лайнуса Полинга, который предложил изображать молекулу бензола в виде шестиугольника с вписанной окружностью, подчёркивая тем самым отсутствие фиксированных двойных связей и наличие единого электронного облака, охватывающего все шесть атомов углерода цикла.
В специальной и популярной литературе распространён термин бензольное кольцо, относящийся, как правило, к углеродной структуре бензола без учёта иных атомов и групп, связанных с атомами углерода. Бензольное кольцо входит в состав множества различных соединений.
На сегодняшний день существует несколько принципиально различных способов производства бензола.
- Коксование каменного угля. Этот процесс исторически был первым и служил основным источником бензола до Второй мировой войны. В настоящее время доля бензола, получаемого этим способом, составляет менее 10 %. Следует добавить, что бензол, получаемый из каменноугольной смолы, содержит значительное количество тиофена, что делает такой бензол сырьем, непригодным для ряда технологичных процессов.
- Каталитический риформинг (аромаизинг) бензиновых фракций нефти. Этот процесс является основным источником бензола в США. В Западной Европе, России и Японии этим способом получают 40—60 % от общего количества вещества. В данном процессе кроме бензола образуются толуол и ксилолы. Ввиду того, что толуол образуется в количествах, превышающих спрос на него, его также частично перерабатывают в:
- бензол — методом гидродеалкилирования;
- смесь бензола и ксилолов — методом диспропорционирования.
- Пиролиз бензиновых и более тяжелых нефтяных фракций. До 50 % бензола производится этим методом. Наряду с бензолом образуются толуол и ксилолы. В некоторых случаях всю эту фракцию направляют на стадию деалкилирования, где и толуол, и ксилолы превращаются в бензол.
 Получение бензола методом Реппе Тримеризация ацетилена — при пропускании ацетилена при 400 °C над активированным углем с хорошим выходом образуется бензол и другие ароматические углеводороды: 3С2Н2 → С6H6. Получение бензола из ацетилена связывают с именем Марселена Бертло[5], работы которого были начаты в 1851 году. Однако продуктом реакции по методу Бертло, протекавшей при высокой температуре, являлась, кроме бензола, сложная смесь компонентов. Лишь в 1948 году В. Реппе удалось найти подходящий катализатор — никель — для снижения температуры реакции.[6]
Получение бензола методом Реппе Тримеризация ацетилена — при пропускании ацетилена при 400 °C над активированным углем с хорошим выходом образуется бензол и другие ароматические углеводороды: 3С2Н2 → С6H6. Получение бензола из ацетилена связывают с именем Марселена Бертло[5], работы которого были начаты в 1851 году. Однако продуктом реакции по методу Бертло, протекавшей при высокой температуре, являлась, кроме бензола, сложная смесь компонентов. Лишь в 1948 году В. Реппе удалось найти подходящий катализатор — никель — для снижения температуры реакции.[6]
Значительную часть получаемого бензола используют для синтеза других продуктов:
В существенно меньших количествах бензол используют для синтеза некоторых других соединений. Изредка и в крайних случаях, ввиду высокой токсичности, бензол используют в качестве растворителя.
Кроме того, бензол входит в состав бензина. В 1920-х — 1930-х годах, бензол добавлялиrude в прямогонный бензин для повышения его октанового числа, но к 1940-м годам такие смеси не выдержали конкуренции с высокооктановыми бензинами. Ввиду высокой токсичности содержание бензола в топливе ограничено современными стандартами введением до 1 %.
Биологическое действие и токсикология[править | править код]

Бензол является одним из самых распространённых ксенобиотиков антропогенного происхождения.
Бензол сильно ядовит. Согласно ГОСТ 12.1.005-88 он относится ко II классу опасности (высокоопасные вещества). Минимальная летальная доза при пероральном приёме составляет 15 мл, средняя 50-70 мл. При непродолжительном вдыхании паров бензола не возникает немедленного отравления, поэтому до недавнего времени порядок работ с бензолом особо не регламентировался. В больших дозах бензол вызывает тошноту и головокружение, а в некоторых тяжёлых случаях отравление может повлечь смертельный исход. Первым признаком отравления бензолом нередко бывает эйфория. Пары бензола могут проникать через неповрежденную кожу. Жидкий бензол довольно сильно раздражает кожу. Если организм человека подвергается длительному воздействию бензола в малых количествах, последствия также могут быть очень серьёзными.
Бензол является сильным канцерогеном. Исследования показывают связь бензола с такими заболеваниями, как апластическая анемия, острые лейкозы (миелоидный, лимфобластный), хронический миелоидный лейкоз, миелодиспластический синдром и заболевания костного мозга[7][8].
Механизм трансформации и мутагенное воздействие бензола[править | править код]
Существует несколько вариантов механизма трансформации бензола в организме человека. В первом варианте происходит гидроксилирование молекулы бензола микросомальной системой окисления при участии цитохрома P450. Согласно механизму, бензол окисляется сначала до высокореакционного эпоксида, который далее преобразуется в фенол. Помимо этого происходит генерация свободных радикалов (активные формы кислорода), вследствие высокой активации Р450 по реакции:
Цит Р450 + NADPH + H— + O2→ Цит Р450 + NADP+ + HOOH.
HOOH → 2ОH·
C6H6 + ОH·→C6H5OH.
Таким образом бензол проявляет радиомиметический эффект (эффект сходный с воздействием ионизирующего излучения).
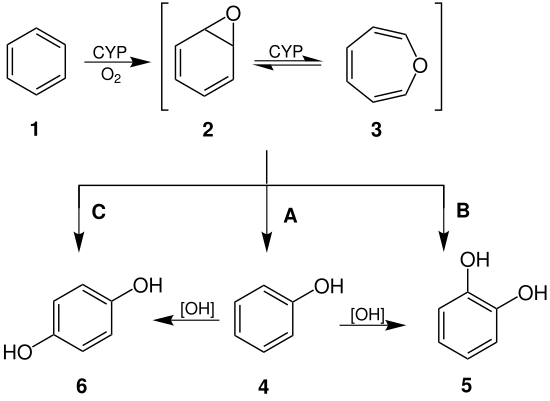
Молекулярный механизм мутагенеза бензола[править | править код]
Бензол является промутагеном, мутагенные свойства он приобретает только после биотрансформации, в результате которой образуются соединения с высокой реакционной способностью. Одним из таких является эпоксид бензола. Вследствие высокого углового напряжения эпоксидного цикла происходит разрыв связей -С-О-С- и молекула становится электрофилом, она легко вступает в реакцию с нуклеофильными центрами азотистых оснований молекул нуклеиновых кислот, в особенности ДНК.
Механизм взаимодействия эпоксидного цикла с нуклеофильными центрами — аминогруппами азотистых оснований (реакция арилирования) — протекает как реакция нуклеофильного замещения SN2. В результате образуются довольно прочные ковалентно-связанные ДНК-аддукты, наиболее часто такие дериваты наблюдаются у гуанина (так, как молекула гуанина имеет максимальное количество нуклеофильных центров), например, N7-фенилгуанин. Образовавшиеся ДНК-аддукты могут приводить к изменению нативной структуры ДНК, тем самым нарушается правильное протекание процессов транскрипции и репликации, что является источником генетических мутаций. Накопление эпоксида в гепатоцитах (клетках печени) ведёт к необратимым последствиям: увеличению арилирования ДНК, а вместе с тем и к увеличению экспрессии (сверхэкспрессии) мутантных белков, являющихся продуктами генетической мутации; торможению апоптоза; трансформации клеток и даже гибели. Помимо яркой выраженной генотоксичности и мутагенности, бензол обладает сильной миелотоксичностью и канцерогенной активностью, особенно этот эффект проявляется в клетках миелоидной ткани (клетки данной ткани очень чувствительны к подобному роду воздействиям ксенобиотиков).
Бензол и токсикомания[править | править код]
Бензол оказывает на человека одурманивающее воздействие и может приводить к наркотической зависимости.
Острое отравление[править | править код]
При очень высоких концентрациях — почти мгновенная потеря сознания и смерть в течение нескольких минут. Окраска лица синюшная, слизистые оболочки часто вишнёво-красные. При меньших концентрациях — возбуждение, подобное алкогольному, затем сонливость, общая слабость, головокружение, тошнота, рвота, головная боль, потеря сознания. Наблюдаются также мышечные подёргивания, которые могут переходить в тонические судороги. Зрачки часто расширены, не реагируют на свет. Дыхание сначала учащено, затем замедлено. Температура тела резко снижается. Пульс учащенный, малого наполнения. Кровяное давление понижено. Известны случаи сильной сердечной аритмии.
После тяжёлых отравлений, которые не приводят непосредственно к смерти, иногда наблюдаются длительные расстройства здоровья: плевриты, катары верхних дыхательных путей, заболевания роговицы и сетчатки, поражения печени, сердечные расстройства и т. д. Описан случай вазомоторного невроза с отёком лица и конечностей, расстройствами чувствительности и судорогами через короткое время после острого отравления парами бензола. Иногда смерть наступает спустя некоторое время после отравления.
Хроническое отравление[править | править код]
В тяжёлых случаях наблюдаются: головные боли, чрезвычайная утомляемость, одышка, головокружение, слабость, нервность, сонливость или бессонница, расстройство пищеварения, тошнота, иногда рвота, отсутствие аппетита, учащение мочеиспускания, менструаций, нередко развиваются упорные кровотечения из слизистой оболочки рта, особенно дёсен, и носа, длящиеся часами и даже сутками. Иногда упорные кровотечения наблюдаются после удаления зуба. Многочисленные мелкие геморрагии (кровоизлияния) в коже. Кровь в испражнениях, маточные кровотечения, кровоизлияния в сетчатку. Обычно именно кровотечения, а часто и сопутствующая им лихорадка (температура до 40° и выше) приводят отравленных в больницу. В подобных случаях прогноз всегда серьёзен. Причиной смерти иногда являются вторичные инфекции: известны случаи гангренозного воспаления надкостницы и некроза челюсти, тяжёлых язвенных воспалений дёсен, общего сепсиса с септическим эндометритом.
Иногда при тяжёлых отравлениях развиваются симптомы нервных заболеваний: повышение сухожильных рефлексов, двусторонний клонус, положительный симптом Бабинского, расстройство глубокой чувствительности, псевдотабетические расстройства с парестезиями, атаксией, параплегией и двигательными нарушениями (признаки поражения задних столбов спинного мозга и пирамидных путей)[9].
Наиболее типичны изменения крови. Число эритроцитов обычно резко снижено, вплоть до 1—2 млн и ниже. Содержание гемоглобина также сильно падает, иногда до 10 %. Цветной показатель в части случаев низок, иногда близок к нормальному, а порой высок (особенно при сильной анемии). Отмечают анизоцитоз и пойкилоцитоз, базофильную пунктацию и появление ядерных эритроцитов, увеличение числа ретикулоцитов и объёма эритроцитов. Типичнее резкое уменьшение числа лейкоцитов. Иногда первоначально лейкоцитоз, быстро сменяющийся лейкопенией, ускорение СОЭ. Изменения со стороны крови развиваются не одновременно. Чаще всего раньше поражается лейкопоэтическая система, позже присоединяется тромбоцитопения. Поражение эритробластической функции часто наступает ещё позже. В дальнейшем может развиться характерная картина тяжёлого отравления — апластическая анемия.
Явления отравления могут сохраняться и даже прогрессировать через месяцы и годы после прекращения работы с бензолом.
Первая помощь при отравлении и лечение[править | править код]
При остром отравлении бензолом (парами бензола) пострадавшего необходимо в первую очередь вынести на свежий воздух, в случае остановки дыхания проводят искусственное дыхание до нормализованного, в качестве стимуляторов дыхания применяют кислород и лобелин. Применение адреналина в качестве аналептика категорически запрещено! При возникновении рвоты внутривенно 40 % раствор глюкозы, в случае нарушения кровообращения — инъекцию раствора кофеина. Если отравление произошло перорально и бензол попал в желудок, необходимо промыть его с помощью растительного масла (хорошо абсорбирует бензол), процедуру следует проводить с осторожностью, так как возможна аспирация. При лёгких отравлениях больному показан покой. При возбуждённых состояниях необходимы седативные средства. При возникновении анемии проводят переливания крови, витамин B12, фолиевая кислота, при лейкопении — витамин B6, пентоксил. В случае снижения иммунитета (иммунодефицитное состояние) — иммуностимуляторы.
Действие бензола на биомембраны[править | править код]
Биологические мембраны представляют собой надмолекулярные структуры — двойной липид
Толуол в бензина: что будет при добавлении, все за и против, повышение октанового числа бензина толуолом
Толуол, также известный как метилбензол — жидкость без цвета, обладающая резким и едким запахом. Она образуется при переработке нефти — в процессе каталитического риформинга бензиновых фракций. Используется при получении бензола, бензойной кислоты, нитротолуола и других летучих веществ.
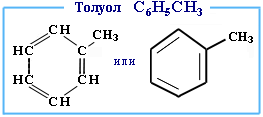
Толуол является одним из значимых видов сырья для химической промышленности. Это отличный растворитель, поэтому используется практически во всех товарных растворителях (содержанием от 40 до 70 %), в составе лаков и красок. Применяется в процессах химического синтеза, легко смешивается в любом количестве с углеводородами, спиртами, простыми и сложными эфирами.
Обладает высоким октановым числом — 115,7 по исследовательскому методу. Это свойство предопределяет использование толуола (а также бензола и ксилола) в качестве октанповышающей добавки к бензину. Все три вещества относятся к простейшим ароматическим углеводородам, поэтому бензин, содержащий их, называют «ароматическим».
Как повысить октановое число бензина толуолом?
Увеличение октанового числа бензина и повышение его детонационной стойкости можно осуществить различными добавками. Раньше для этой цели применяли тетраэтилсвинец и нафталин, но затем первый запретили ввиду крайней ядовитости, а второй перестали использовать из-за частых случаев закупоривания кристаллами бензопроводов и форсунок и увеличения нагарообразования на поршнях.
Сегодня для этих целей используют:
- ацетон,
- монометиланилин (ММА),
- марганец,
- ферроцен,
- метилтретбутиловый эфир (МТБЭ),
- толуол и другие вещества.
Все перечисленные компоненты вместе с положительным воздействием (повышение октанового числа, улучшение сгорания топлива, уменьшение детонации) обладают и отрицательными свойствами, отличающимися своими последствиями друг от друга. Одни увеличивают детонацию при неправильной дозировке, другие способствуют чрезмерному образованию нагара, третьи разъедают прокладки или «садят» катализатор, четвёртые быстро распадаются и прекращают своё действие, пятые увеличивают количество вредных веществ в выхлопах двигателя, следующие уменьшают мощность двигателя и увеличивают процессы коррозии и т. п.
Толуол в бензине используют чаще других корректоров для улучшения качества имеющегося топлива. Объясняется это сравнительно лёгкой доступностью, хотя в магазине его приобрести непросто, а также невысокой стоимостью.
О том, как самостоятельно добавлять толуол в бензин, можно узнать из интернета. Некоторые практикуют соотношение 1:20, другие вливают его меньше — до 1:100.
Из рецептуры состава, служащего для превращения бензина А-76 в АИ-95, применяемого в одной из компаний, видно, что содержание толуола в нём — 15 массовых процентов, высокооктановой кислородосодержащей добавки — 4,7 %. В другой рецептуре (получения АИ-98 из АИ-92) к бензину добавляют 5 % толуола, 5 % эфира МТБЭ, 4,7 % добавки высокооктановой кислородосодержащей и 0,01 % присадки Октан-максимум.
Толуол в бензине: за и против
Толуол как добавка в бензин активно используется производителями и распространённых марок топлива, и специфических, изготавливаемых, например, для спортивных машин. Последние виды бензина требуют высокого октанового числа — больше 100 единиц, и толуол вместе с другими компонентами служит для достижения этой цели.
К негативным свойствам толуола относят его вред, причиняемый здоровью людей. Длительные контакты с жидкостью или вдыхание паров могут вызывать со временем отравления, чреватые поражениями нервной системы. Он также может влиять на систему кроветворения организма. Работать с веществами, содержащими толуол, нужно только в перчатках, поскольку он способен проникать через кожные покровы. Необходимо также следить за обеспечением хорошей вентиляции помещения.
Если вам понравилась наша статья и мы как-то смогли ответить на ваши вопросы — то будем очень благодарны за хороший отзыв о нашем сайте!
Толуол октановые числа — Справочник химика 21
Октановые числа смешения газовых бензинов, бензинов прямой перегонки из парафинистого и смешанного сырья некоторых технически чистых углеводородов изостроения обычно близки к их октановым числам в чистом виде. Бензиновые фракции каталитических процессов и продукты алкилирования, полимеризации и изомеризации имеют октановые числа смешения несколько выше, чем в чистом виде. Октановые числа смешения бензола, толуола и ксилолов ниже, чем их октановые числа в чистом виде. Алки-лированные бензолы с разветвленной боковой цепью имеют октановые числа смешения более высокие, чем в чистом виде. Октановое число смешения высокооктанового компонента обычно тем выше, чем ниже октановое число базового топлива. [c.164]Все эти простейшие ароматические углеводороды — бензол, толуол и ксилолы — повышают октановое число бензина. Содержащий их бензин иногда называют аро- [c.59]
Для облегчения расчетов обычно выбирают наиболее значимые эксплуатационные показатели качества и наиболее массовые (т.е. высокотаннажные), так называемые базовые компоненты топлива. Для высокооктановых автобензинов в качестве наиболее значимых показателей качества принято считать детонационную стойкость и испаряемость, а в качестве базовых компонентов — бензиновые фракции многотоннажных процессов прямой перегонки, каталитического риформинга, каталитического крекинга, гидрокрекинга, реже термодеструктивных процессов. Для улучшения тех или иных характеристик смеси бензиновых компонентов применяют высокооктановые компоненты-добавки, такие, как алкилаты, изомеризаты, эфиры, и низкокипящие углеводороды бутановую, изобутановую, изопента-новую, пентан-амиленовую фракции, газовый бензин, бензол, толуол и т.д., а также этиловую жидкость и присадки. Детонационная стойкость является часто решающим показателем, определяющим компактный состав товарных высокооктановых автобенэинов. Требуемая высокая детонационная стойкость достигается, во-первых, использованием наиболее высокооктановых базовых бензинов и увеличением их доли в компонентном составе автобензина, во-вторых, добавлением высокооктановых компонентов и, в-третьих, применением антидетона-ционных присадок в допустимых пределах. При разработке рецептуры товарных высокооктановых автобенэинов следует оперировать октановыми числами не чистых компонентов, а смесительной их характеристикой, т.е. октановыми числами смешения стремиться обеспечить равномерность распределения детонационной стойкости по фракциям и, хотя это не предусмотрено в современных ГОСТ, желательно, чтобы содержание ароматических углеводородов составляло не более 45 -50% и бензола — не более 6%. Для удовлетворения требований по их испаряемости, т.е. по фракционному составу и давлению насыщенных паров, в базовые компоненты, как правило, вводят низкокипящие компоненты. Выбор базовых высокооктановых и низкокипящих [c.216]
Толуол Октановое число 104 [c.9]
Вторичная перегонка бензинового дистиллята, представляет собой либо самостоятельный процесс, либо является частью комбинированной установки, входящей в состав нефтеперерабатывающего завода. На современных заводах установки вторичной перегонки бензинового дистиллята предназначены для получения из него узких фракций. Эти фракции используют в дальнейшем как сырье каталитического риформинга — процесса, в результате которого получают индивидуальные ароматические углеводороды — бензол, толуол, ксилолы, либо бензин с более высоким октановым числом. При производстве ароматических углеводородов исходный бензиновый дистиллят разделяют на фракции с температурами выкипания 62—85 С (бензольную), 85—115 (120) °С (толуольную) и 115 (120)—140 С (ксилольную). [c.18]
Так, каталитическим крекингом получают дополнительные количества высокооктановых бензинов, посредством каталитического риформинга повышают октановое число бензинов и получают ароматические углеводороды (бензол, толуол, ксилолы и этилбензол). Гидроочистка позволяет производить реактивные и дизельные топлива с малым содержанием серы. Процесс пиролиза дает возможность получить из нефти важнейшее сырье для нефтехимии этилен, пропилен, бутилены и моноциклические ароматические углеводороды, а также сырье для производства высококачественных сажи и электродного кокса. [c.198]
Повышенная детонационная стойкость фракций 102—112° объясняется присутствием в этих фракциях большого количества толуола октановое число их колеблется от 88 до 95, а сортность от 118 до 191. [c.286]
На рис. 12 показано влияние углеводородного состава сырья и начала его кипения на выход бензина с октановым числом 95 [4]. При каталитическом риформинге можно также получать индивидуальные ароматические углеводороды бензол, толуол, этилбензол и изомеры ксилола. В этом случае сырьем процесса являются более узкие фракции,- выкипающие в зависимости от целевого продукта в пределах 62—105°С (или 62—120°С), 105—140°С (или 120—140 °С). [c.40]
Высокооктановые компоненты авиационных топлив, вырабатываемые нефтяной промышленностью, включают в основном продукты алкилирования изобутана бутиленами и бензола пропиленом. Наряду с этим в качестве компонентов бензина, повышающих его октановое число, применяют смесь бензола, толуола и ксилола (пиробензол), изопентан, технический изооктан. [c.136]
Ниже сравниваются октановые числа (ОЧММ) этилированных смесей углеводородов в присутствии сероорганических соединений (смесь 1—56% изооктана +44% гептана смесь 2 — 40% толуола + + 30% гептана 20% диизобутилена + 10% изооктана) [c.137]
Эффективность добавления антидетонатора к ароматическим углеводородам не изучалась с такой тщательностью, как это имело место при исследовании других типов углеводородов. Эти-лирование ароматических соединений приводит к самым противоположным результатам даже различные изомеры одного и того же соединения могут характеризоваться различной приемистостью среди них могут быть и такие, у которых ТЭС вызывает большое повышение октанового числа, и такие, для которых ТЭС служит возбудителем детонации. ТЭС является легким возбудителем детонации бензола эффективность этилирования толуола, этил-, н-пропил, н-бутилбензола анало
Какой бензин лучше — гоночный АИ-102 или обычный АИ-98? — журнал За рулем
Сравниваем два бензина АИ-102 с обычным АИ-98. Что дает высокое октановое число? И кому оно полезно?
01
Еще недавно самые динамичные отечественные машины с ладьей на решетке радиатора требовали 93‑й бензин. Нынче самый востребованный — 95‑й. Но многие модели, особенно с наддувом, просят уже 98‑й. Тенденция простая: чем круче мотор, тем больший октан ему подавай.
А ведь в природе есть и более серьезные бензины — с октановым числом 102, 106 и даже 110! Их на АЗС не купишь — только в специализированных фирмах. Жутко дорого, но вдруг машина полетит?
Итак, вопрос: что дает высокое октановое число? И дает ли хоть что-то? И кому оно полезно?
БЕНЗИНОВОЕ БОРОДИНО
Выбор 102‑х бензинов в России небольшой. Но наша задача не сравнительная, а аналитическая. Мы хотим понять, откуда берется эффект и насколько он значим. А для этого вполне хватит двух сортов спортивных бензинов.
02
Мы раздобыли российский бензин ТОТЕК Торнадо С‑102 и французский ELF LM S АИ‑102. Такое вот мини-Бородино: наш против «француза». А в качестве эталона берем заведомо качественный бензин АИ‑98‑К5.
Материалы по теме
Результаты анализа физико-химических показателей образцов топлива мы свели в таблицу. Отметим, что у обоих спортивных бензинов октановое число по исследовательскому методу (ОЧИ) чуть меньше, чем заявленное в названии «102», — примерно 101,6–101,8. На это обращают внимание и разработчики — мол, это сделано специально, чтобы ни в коем случае не выйти за предельное значение ОЧИ, определенное правилами FIA. Аналогичная ситуация с октановым числом по моторному методу (ОЧМ) — чуть недотягивает до нормированных 90 единиц.
Кроме того, в 102‑х бензинах выше содержание связанного кислорода, хотя и в меру: в бензине ТОТЕК Торнадо его нашлось 2,9%, в бензине ELF — 2,6%. Углеводородный анализ показал, что ароматических углеводородов в ТОТЕКе больше — это определяет его более высокую теплотворность. А в бензине ELF обнаружились следы азотсодержащих соединений, но в разрешенном количестве.
В общем, мы убедились, что оба бензина вполне соответствуют требованиям FIA к спортивным бензинам. А заодно выяснили, что им соответствует и обычный 98‑й.
table-01
Так зависит давление в цилиндре от изменения угла опережения зажигания при одинаковой частоте вращения коленчатого вала и одном и том же положении дроссельной заслонки. Чем раньше поджигаем топливо, тем выше максимальное давление в цилиндре — ведь большая часть сгорания происходит на ходе сжатия. При слишком раннем зажигании появляется детонация. Обратите внимание на мощность при разных углах опережения зажигания по коленвалу (УОЗ ПКВ): мотору не нравятся ни слишком ранние, ни слишком поздние — нужна оптимальная регулировка, при которой мощность будет максимальной, а расход топлива минимальным.Так зависит давление в цилиндре от изменения угла опережения зажигания при одинаковой частоте вращения коленчатого вала и одном и том же положении дроссельной заслонки. Чем раньше поджигаем топливо, тем выше максимальное давление в цилиндре — ведь большая часть сгорания происходит на ходе сжатия. При слишком раннем зажигании появляется детонация. Обратите внимание на мощность при разных углах опережения зажигания по коленвалу (УОЗ ПКВ): мотору не нравятся ни слишком ранние, ни слишком поздние — нужна оптимальная регулировка, при которой мощность будет максимальной, а расход топлива минимальным.
СТЕНДОВЫЕ МОТОРНЫЕ ИСПЫТАНИЯ
Основных вопросов два. Что получится, если использовать 102‑й в двигателях, изначально ориентированных на бензин с октановым числом 95–98? И как отреагируют заряженные версии этих моторов?
Для первого «заезда» на моторный стенд был установлен обычный вазовский шестнадцатиклапанник ВАЗ‑21126 со штатной системой управления. При замерах нас в первую очередь интересовало изменение мощности двигателя и расхода топлива.
Одна из известных страшилок, до сих пор бытующая в народе, гласит, что при использовании слишком высокооктанового топлива можно спалить клапаны. А причиной этого является повышенная температура отработавших газов — из-за якобы более медленного горения топлива с увеличенной

 (
(
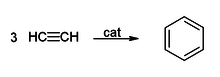 Получение бензола методом Реппе Тримеризация ацетилена — при пропускании ацетилена при 400 °C над активированным углем с хорошим выходом образуется бензол и другие ароматические углеводороды: 3С2Н2 → С6H6. Получение бензола из ацетилена связывают с именем Марселена Бертло[5], работы которого были начаты в 1851 году. Однако продуктом реакции по методу Бертло, протекавшей при высокой температуре, являлась, кроме бензола, сложная смесь компонентов. Лишь в 1948 году В. Реппе удалось найти подходящий катализатор — никель — для снижения температуры реакции.[6]
Получение бензола методом Реппе Тримеризация ацетилена — при пропускании ацетилена при 400 °C над активированным углем с хорошим выходом образуется бензол и другие ароматические углеводороды: 3С2Н2 → С6H6. Получение бензола из ацетилена связывают с именем Марселена Бертло[5], работы которого были начаты в 1851 году. Однако продуктом реакции по методу Бертло, протекавшей при высокой температуре, являлась, кроме бензола, сложная смесь компонентов. Лишь в 1948 году В. Реппе удалось найти подходящий катализатор — никель — для снижения температуры реакции.[6]