Спирты горение — Справочник химика 21
Этиловый спирт хорошо горит. В его молекуле уже есть немного кислорода, поэтому он выделяет при горении только той энергии, какую выделяют углеводороды. Кроме того, этиловый спирт дороже бензина. И тем не менее очень может быть, что когда нефтяные месторождения будут близки к истощению, нам придется использовать этиловый спирт как горючее для автомобилей. [c.92]При полном горении продуктами сгорания являются диоксид углерода, вода, азот, сернистый ангидрид, фосфорный ангидрид. При неполном горении обычно образуются токсичные, агрессивные, горючие и взрывоопасные продукты оксид углерода, спирты, кетоны, альдегиды кислоты и другие соединения. [c.121]
Многочисленные опыты показывают, что в среде жидкого кислорода и воздуха горение ряда органических веществ протекает более интенсивно. Необходимо при этом, чтобы реакция началась до соприкосновения с жидким кислородом или воздухом. Например, уголь дуговой лампы, один из концов которого нагрет до красна, при погружении в прозрачный сосуд Дьюара с жидким кислородом продолжает гореть очень спокойно с интенсивным выделением света и теила. Бурная реакция происходит при погружении в сосуд с жидким кислородом раскаленных проволок из стали и магния. В ряде случаев реакция горения сопровождается взрывом. Например, прп погружении в жидкий воздух горящего кусочка фосфора происходит сильный взрыв. Смеси жидкого кислорода со спиртом и керосином обладают очень сильными взрывчатыми свойствами при наличии достаточного импульса. Эти свойства жидких воздуха и кислорода позволили использовать их для получения взрывчатых веществ. В качестве взрывчатого вещества вначале применяли древесные опилки, пропитанные жидким воздухом, обогащенным кислородом. В настоящее время взрывчатые вещества, представляющие смесь тонко измельченного горючего вещества с жидким кислородом, получили название оксиликвитов [22] и их широко применяют в промышленности.
Достаточно высокие температуры кипения и низкие температуры замерзания спиртов дают возможность применять их в широком диапазоне температур эксплуатации. Спирты, как и углеводороды, отличаются незначительной коррозионной активностью по отношению к металлам. Поэтому баки и топливную аппаратуру двигателя изготовляют из обычных доступных и недорогих материалов. Хорошие эксплуатационные свойства, относительно низкая температура горения, высокая устойчивость горения и хорошая охлаждающая способность обусловили выбор спиртов в качестве горючих в ранний период развития жидкостных ракетных двигателей. Спирты как ракетное горючее не потеряли своего значения до настоящего времени. [c.122]
Окисление спиртов. Горение спиртов можно рассматривать как полное их окисление с образованием двуокиси углерода и воды [c.88]
Теплоты горения и образования некоторых спиртов, фенолов и кетонов [И]
Температурой вспышки называется та низшая темпе ратура, при которой пожароопасная жидкость, испаряясь, образует с воздухом смесь, способную воспламениться при поднесении к ней источника зажигания. При вспышке количество выделившегося тепла недостаточно для того, чтобы вызвать новое выделение паров жидкости и воспламенить саму жидкость, поэтому горение прекращается. Температура вспышки — один из важнейших параметров, по которому определяется степень пожароопасности жидкости. Жидкости с температурой вспышки паров до 45 С, например эфир, бензол или метиловый спирт, называются легковоспламеняющимися (ЛВЖ), а с температурой вспышки выше 45 °С, например глицерин, нитробензол, фурфурол, этиленгликоль,— горючими жидкостями (ГЖ). Знание температуры вспышки имеет большое значение. для пожарной профилактики для надлежащего размещения зданий и аппаратуры, применения строительных конструкций и материалов, разработки мер по тушению пожаров и эвакуации людей. [c.31]
Медленное окисление связи С—Н до группы С—О—О—Н под действием атмосферного кислорода называется автоокислением (применительно к окислению медленное означает идущее без горения) [179]. Этот процесс наблюдается при стоянии веществ на воздухе и катализируется светом, так что если автоокисление нежелательно, его можно существенно замедлить, держа вещество в темноте. Образующиеся пероксиды часто претерпевают дальнейшее превращение в спирты, кетоны и более сложные соединения, поэтому реакция редко используется в препаративных целях, однако в некоторых случаях удается нолучить пероксиды с высокими выходами [179а]. Именно из-за автоокисления пищевые продукты, резина, краски, смазочные масла и другие материалы с течением времени портятся и разрушаются под атмосферным воздействием. С другой стороны, благодаря автоокислению лаки и краски высыхают на воздухе. Как и в других свободнорадикальных реакциях, некоторые связи С—Н легче атакуются, чем другие [180] наиболее реакционноспособны третичные связи (см. также разд. 14.5), однако при повышенных температурах и в газовой фазе селективность очень низка. Реакцию можно успешно провести с третичными (реже вторичными), аллильными и бензильными соединениями [181] окисление аллильных соединений обычно сопровождается перегруппировками. Наиболее типичные примеры приведены ниже
Процесс удаления нагара при подаче смеси спирта с водой происходит более стабильно. При больших относительных расходах смеси (кривая 7 на рис. 117 снята при впр=0,0276 кг/кг сухого воздуха) наблюдается пульсирующий характер изменения температуры в сторону ее повышения. Такой характер изменения температуры стенки под слоем нагара объясняется тем, что часть спирта, входящего в состав первичного воздуха поступающего в зону горения, способствует выгоранию ранее отложившегося нагара. Это предположение было подтверждено специальными экспериментами. В экспериментальную форкамеру вместо топлива Т-1пп вспрыскивали такое же количество этилового спирта (кривая 8 на рис. 117). При впрыскивании этилового спирта в форкамеру А ст=107°С, а при работе на топливе Т-1пп А/ст=142°С. [c.280]
Рассмотренная теория применима к расчету испарения и диффузионного горения как капель индивидуальных химических веществ (
www.chem21.info
2C2h5oh(жидк.) c2h5oc2h5(жидк.) h3o(жидк.)
1. Экзотермические и эндотермические реакции.
2. Тепловой эффект химической реакции. Понятие об энтальпии.
3. Термохимические уравнения.
4. Теплота образования. Теплота сгорания.
5. Закон Гесса и следствия из него.
Химические реакции протекают с выделением или поглощением энергии (обычно в виде теплоты).
Химические реакции, протекающие с выделениемтеплоты, называютсяэкзотермическими — Q0, а реакции, протекающие споглощениемтеплоты, –эндотермическими — Q<0.
Количество теплоты, которое выделяется или поглощается в результате химической реакции, называется тепловым эффектомреакции (Q). Тепловой эффект выражается в кДж или ккал (1 ккал = 4,187 кДж).
Уравнения химических реакций, в которых записывается тепловой эффект реакции, называют термохимическими уравнениями.
Величина Q указывается в правой части уравнения со знаком «+» в случае экзотермической реакции и со знаком «–» в случае эндотермической реакции. В термохимическом уравнении указываются агрегатные состояния реагентов и продуктов реакции, т.к. тепловой эффект реакции зависит от агрегатных состояний реагирующих веществ. По термохимическим уравнениям можно проводить различные расчеты, т.к. тепловой эффект реакции относится к мольным количествам исходных веществ и продуктов реакции. Также термохимические уравнения можно записывать с величиной изменения энтальпии (Н).
Теплота образования– это теплота, которая выделяется или поглощается при образовании 1 моль сложного вещества из простых веществ при стандартных условиях.Теплоты образования простых веществ приняты равными нулю.
Стандартные условия– давление 1 атм (101,3 кПа), Т = 298К (25 °С).
Теплота сгорания– это теплота, выделяющаяся при сгорании 1 моль вещества в кислороде при стандартных условиях с образованием оксида элемента в высшей степени окисления.Теплоты сгорания негорючих веществ равны нулю.
Теплоты сгорания и образования – справочные величины, они приводятся в справочных термодинамических таблицах при стандартных условиях.
Название | Обозначение, размерность | Определение, физический смысл | Расчет |
Энтальпия | Н кДж/моль Нобро298 | Тепловой эффект химической реакции при постоянном давлении. Экзотермическая реакция —Н0, тепло выделяется. Эндотермическая реакция —Н0,тепло поглощается. Теплота образования 1 моль вещества из простых веществ, устойчивых при стандартных условиях. | Закон Гесса (1840 г): Тепловой эффект химической реакции зависит только от начального и конечного состояния веществ и не зависит от промежуточных стадий процесса. 1 следствие (всегда): тепловой эффект реакции равен сумме теплот образования продуктов реакции за вычетом сумм теплот образования исходных веществ (с учетом коэффициентов) Нх.р.=Нобр.прод.-Нобр.исх. 2 следствие (для горючих веществ): тепловой эффект химической реакции равен сумме теплот сгорания исходных веществ за вычетом суммы теплот сгорания продуктов реакции (с учетом коэффициентов) Нх.р. =Нсгор. исх -Нсгор. прод |
2С(графит)
+ 3Н2(газ)
С2Н6(газ), Н1 = Н
обр.(С2Н6)
2Натомиз 3Натомиз Н Н 



2
С (газ) + 6Н (ат) -Ес-с — 6Е
с-н Н —С-С —
Н

Н Н
Н обр.(С2Н6) = 2Натомиз + 3Натомиз-Ес-с — 6Е с-н
Вычислить теплоту реакции получения гидроксида кальция из оксида кальция и воды, если теплота образования оксида кальция равна +635,7 кДж/моль, теплота образования воды равна +285,8 кДж/моль, а теплота образования гидроксида кальция равна +986,8 кДж/моль.
Решение
Q р-ции = Qобр.прод. – Q обр. реаг. = Q обр. Са(ОН)2 – (Q обр.СаО + Q обр. Н2О) = 986,8 – (635,7 + 285,8) = 65,3 кДЖ/моль
Ответ. 65,3 кДж/моль.
Окисление глюкозы в организме может протекать по реакции:
С6Н12О6 (тв.) + 6О2 (г.) = 6СО2 (г.) + 6Н2О (ж.), Н = –2803 кДж.
Какое количество теплоты выделится при окислении 800 г глюкозы?
Решение
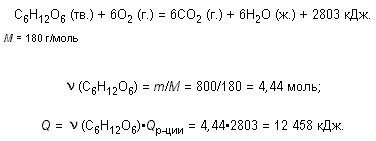
Ответ. 12 458 кДж.
Определите количество теплоты, которое выделится при образовании 120 г MgO в результате реакции горения магния, с помощью термохимического уравнения.
2 Mg + O2 = 2MgO + 1204 кДж
Решение
1) Определяем количества оксида магния, используя формулу для нахождения количества вещества через массу. ν = m / M
ν(MgO) = 120г: 40 г/моль = 3 моль
2) Составляем пропорцию с учетом коэффициентов в уравнении реакции
По уравнению 2 моль MgO — 1204 кДж
По условию 3 моль MgO — Q
Отсюда Q= (3 * 1204):2 = 1803кДж
Ответ: При образовании 120г оксида магния выделится 1803 кДж энергии.
В результате реакции, термохимическое уравнение которой
2 C2H2+ 5O2 = 4CO2 +2H2O + 2610 кДж выделилось 652,5 кДж теплоты. Определите массу сгоревшего ацетилена.
Решение
1) Установим пропорциональные отношения между количеством вещества ацетилена и количеством теплоты.
По уравнению 2 моль C2H2———- 2610 кДж
По условию х моль ———- 652,5 кДж
Решаем пропорцию х=(2 * 652,5):2610
2) Определяем массу ацетилена по формуле m= n * M
m = 0,5 моль * 26 г/моль = 13 г.
Ответ: масса сгоревшего ацетилена 13 г.
В результате горения 48 г метана выделилось 2406 кДж теплоты. Составьте термохимическое уравнение этой реакции.
Решение
Запишем уравнение реакции горения метана в общем виде
CH4+ 2O2= CO2+2H2O + Q
2. Определим количество 48 г метана
ν = m / M
ν(CH4) = 48г: 16 г/моль = 3 моль
3. Составляем пропорцию с учетом коэффициентов в уравнении реакции
По условию 3моль CH4 — 2406 кДж
По уравнению 1 моль CH4— Q
Решаем пропорцию Q=(1*2406):3=802кДж
Ответ: термохимическое уравнение реакции горения метана
CH4+ 2O2 = CO2 +2H2O + 802 кДж
Рассчитайте тепловой эффект реакции:
4NH3(г) + 3O2(г) = 2N2(г) + 6H2O(ж),
если ΔH0обр NH3(г) и H2O(ж) равны соответственно -286 и -46 кДж/моль.
Решение
1. O2иN2– простые вещества, следовательно тепловой эффект образования их равен нулю.
2. Согласно следствию из закона Гесса, тепловой эффект реакции равен разности между суммами теплот образования продуктов реакции и теплот образования исходных веществ с учетом стехиометрических коэффициентов:
ΔH0 = 6·(-286) – 4·(-46)=-1532 кДж.
Термохимическое уравнение будет иметь вид
4Nh4(г) + 3O2(г) = 2N2(г) + 6h3O(ж)+1532 кДж
Ответ: в результате данной реакции выделится 1532 кДж.
Определить тепловой эффект реакции гидролиза нитрида магния
Mg3N2(тв.) + 6H2O(ж.) = 3Mg(OH)2(тв.) + 2NH3(г.).
Решение
H = Hобр.прод. –Hобр.исх.
Используя справочные данные, находим теплоты образования продуктов и исходных веществ:
H обр. (Mg3N2(тв.)) = –461,5 кДж/моль;
H обр. (Mg(OH)2(тв.)) = –924,66 кДж/моль;
H обр. (H2O(ж.) = –285,77 кДж/моль;
H обр. (NH3(г.) = –46,19 кДж/моль;
Отсюда
H0= [3×(–924,66) + 2×(–46,19)] – [–461,5 + 6×(–285,77)] == –689,86 кДж/моль.
Вычислить стандартную энтальпию реакции:
по значениям стандартных энтальпий сгорания веществ: H0сгор.C2H5OH 1368 кДж/моль; H0сгор.C2H5OC2H5 2727 кДж/моль.
Решение
Запишем выражение второго следствия из закона Гесса с учетом того, что стандартная энтальпия сгорания воды равна нулю:
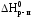 2
2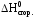 C2H5OH
C2H5OH
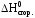 C2H5OC2H5.
C2H5OC2H5.
Подставим значения стандартных
энтальпий сгорания веществ, участвующих
в реакции: 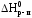 2(1368)
(2727)9
кДж.
2(1368)
(2727)9
кДж.
Ответ: 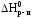 9
кДж.
9
кДж.
При сгорании некоторого количества газообразного углеводорода образовалось 4,48 л оксида углерода (IV) (н.у.) и 3,6 г воды и выделилось 137,5 кДж теплоты. Определите теплоту сгорания углеводорода, если известно, что его плотность по воздуху равна 1,448.
Решение
Определяем простейшую формулу сгоревшего углеводорода:
СхНу + О2→ х СО2+ 0,5у Н2О
ν(СО2) = 4,48 / 22,4 = 0,2 моль;
ν(Н2О) = 3,6/ 18 = 0,2 моль.
ν(С) = 0,2 моль;
ν(Н) = 0,2 · 2 = 0,4 моль.
х :у = 0,2 : 0,4 = 1 : 2. Простейшая формула углеводорода СН2.
Рассчитываем молярную массу и определяем молекулярную формулу углеводорода:
М(СхНу) = Dвоздух · 29 = 1,448 · 29 = 42 г/моль. М(фрагмента СН2) = 14 г/моль
Молекулярная формула углеводорода (СН2)n:
n = М(СхНу) / М(фрагмента СН2) = 42 / 14 = 3.
Углеводород (СН2)3или С3Н6.
Записываем термохимическое уравнение реакции горения углеводорода и определяем теплоту сгорания:
С3Н6(газ) + 4,5 О2(газ) → 3 СО2(газ) + 3 Н2О(ж) + Q(сгорания)
ν(С3Н6) =ν(СО2) / 3 = 0,2 / 3 = 0,0667 моль.
Q(сгорания С2Н6) = Q / ν(С2Н6) = 137,5 / 0,0667 = 2061 кДж/моль.
Ответ: Q(сгорания С2Н6) = 2061 кДж/моль.
При сжигании 9 г органического вещества образовалось 13,2 г оксида углерода(IV) и 5,4 г воды и выделилось 140 кДж теплоты. Определите молекулярную формулу вещества, если его теплота сгорания равна 2800 кДж/моль.
Решение
Судя по продуктам сгорания исходное вещество содержало углерод, водород и,возможно, кислород. Рассчитываем количества образовавшихся веществ, и записываем схему горения:
ν(СО2) = 13,2 / 44 = 0,3 моль.
ν(Н2О) = 5,4 / 18 = 0,3 моль.
СхНуОz + О2→СО2+ Н2О
Рассчитываем количества веществ элементов, входящих в состав исходного вещества и определяем его простейшую формулу:
ν(С) = ν(СО2) = 0,3 моль.
ν(Н) = 2 · ν(Н2О) = 0,3 · 2 = 0,6 моль.
m(O) = m(вещества) – m(С) – m(Н) = 9 – 0,3 · 12 – 0,6 · 1 = 4,8 г.
ν(О) = 4,8 / 16 = 0,3 моль.
х : у : z = 0,3 : 0,6 : 0,3 = 1 : 2 : 1. Простейшая формула вещества СН2О.
Определяем молярную массу вещества и его молекулярную формулу:
ν(исходного вещества) = Q(выделившееся при сгорании взятого количества) :
Q(сгорания) = 140 / 2800 = 0,05 моль.
М(исходного вещества) = 9 / 0,05 = 180 г/моль.
Молекулярная формула (СН2О)n;n = 180 / 30 = 6. С6Н12О6.
Ответ: С6Н12О6.
Тест 1
1. При стандартных условиях теплота образования равна 0 для:
а) водорода; б) воды; в) пероксида водорода; г) алюминия.
2. Реакция, уравнение которой N2 + O2 = 2NO – Q, относится к реакциям:
а) эндотермического соединения; б) экзотермического соединения;
в) эндотермического разложения; г) экзотермического разложения.
3. При взаимодействии 10 г натрия с водой выделяется 36,46 кДж теплоты. Какое количество теплоты (в кДж) выделилось, если в результате реакции образовалось 200 г гидроксида натрия?
а) 838; б) 209,5; в) 364,6; г) 419.
4. Эндотермической является реакция:
а) горения водорода; б) разложения воды; в) горения углерода; г) горения метана.
5. Известны тепловые эффекты следующих процессов:
2С2Н2 (г.) + 5О2 (г.) = 4СО (г.) + 2Н2О (ж.) + 2600 кДж,
Н2О (ж.) = Н2О (г.) – 40 кДж.
Какую массу воды (в г), находящейся при температуре кипения, можно испарить за счет теплоты, полученной при полном сгорании 89,6 л (н.у.) ацетилена?
а) 72; б) 1170; в) 2340; г) 4680.
6. Какое определение неверно для данной реакции:
2NaNO3 (тв.) = 2NaNO2 (тв.) + O2 (г.) – Q?
а) гомогенная; б) эндотермическая; в) реакция соединения; г) окислительно-восстановительная.
7. Даны теплоты реакций:
С + 1/2О2 = СО + 110 кДж,
2СО + О2 = 2СО2 + 566 кДж.
Определить теплоту образования углекислого газа из простых веществ (в кДж/моль).
а) 346; б) 786; в) 503; г) 393.
8. Дано термохимическое уравнение:
2SO2 + O2 = 2SO3 + 198 кДж.
В результате реакции выделилось 495 кДж теплоты. Какая масса (в г) сернистого газа прореагировала с кислородом?
а) 160; б) 640; в) 320; г) 320.
9. Теплота сгорания ацетилена – 1300 кДж/моль. Какое количество теплоты (в кДж) выделится при сгорании 1л ацетилена (в пересчете на н.у.)?
а) 58; б) 116; в) 1300; г) 58 000.
10. Основным законом термохимии является закон:
а) Гей-Люссака; б) Гесса; в) Авогадро; г) Пруста.
Ключ к тесту 1 2 3 4 5 6 7 8 9 10
а, г а г б в а, в г в а б
Тест 2
1. При стандартных условиях теплота образования равна 0 для:
а)углекислого газа ;б) железа ;в) пероксида водорода; г) кислорода.
2. Реакция, уравнение которой N2 + 3Н2 = 2NН3 +Q, относится к реакциям:
а) эндотермического соединения; б) экзотермического соединения;
в) эндотермического разложения; г) экзотермического разложения.
3. При соединении 11,16 г железа с серой выделилось 20,06 кДж теплоты. Определить теплоту образования сульфида железа.
а) 838; б) 100; в) 364,6; г) 419.
4. Эндотермической является реакция:
а) горения водорода; б) разложения воды; в) горения углерода; г) горения метана.
5. Известны тепловые эффекты следующих процессов:
2С2Н2 (г.) + 5О2 (г.) = 4СО (г.) + 2Н2О (ж.) + 2600 кДж, Н2О (ж.) = Н2О (г.) – 40 кДж.
Какую массу воды (в г), находящейся при температуре кипения, можно испарить за счет теплоты, полученной при полном сгорании 89,6 л (н.у.) ацетилена?
а) 72; б) 1170; в) 2340; г) 4680.
6. Какое определение неверно для данной реакции:
СaCO3 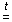 CaO
+ CO2 – Q.?
CaO
+ CO2 – Q.?
а) гомогенная; б) эндотермическая;
в) реакция соединения; г) окислительно-восстановительная.
7. Вычислить теплоту реакции получения гидроксида кальция из оксида кальция и воды, если теплота образования оксида кальция равна +635,7 кДж/моль, теплота образования воды равна +285,8 кДж/моль, а теплота образования гидроксида кальция равна +986,8 кДж/моль.
а) 65,3; б) 786; в) 503; г) 393.
8. Дано термохимическое уравнение:2SO2 + O2 = 2SO3 + 198 кДж.
В результате реакции выделилось 495 кДж теплоты. Какая масса (в г) сернистого газа прореагировала с кислородом?
а) 160; б) 640; в) 320; г) 320.
9. Термохимическое уравнение
реакции горения метана имеет вид:СН4 (г.) + 2О2 (г.) = СО2 (г.) + 2Н2О (г.), 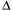 Н = –802,2 кДж.
Н = –802,2 кДж.
Найти, какое количество теплоты выделится при сгорании 44,8 л (н.у.) метана.
а) 1604; б) 116; в) 1300; г) 58 000.
studfile.net
Физико-химические свойства этилового спирта — Мегаобучалка
Этиловый спирт – бесцветная прозрачная жидкость; молярная масса С2Н5ОН 46 г/моль; температура плавления –114,14°С; температура кипения 78,3°С; критическое давление 6,395 МПа; температура вспышки 13°С; температура самовоспламенения 404°С; плотность 0,7893 г/см3; смешивается с водой в любых соотношениях.
Расчет термодинамических величин
2.1. Реакция горения этилового спирта в воздухе:
СnНmOr + ×(O2 + 3,75 N2)
n CO2(г) + H2O(ж) + ×3,75 N2.
Для этилового спирта С2Н5ОН: n=2, m=6, r =1:
C2H5OH(Ж) + 3 (O2 + 3,75N2)(г) 2 CO2(г) + 3H2O(ж) + 11,25 N2.
2.2. Табличное значение стандартной энтальпии сгорания этилового спирта =−1366,91 кДж/моль.
Следовательно, высшая энтальпия сгорания топлива равна:
−1366,91 кДж/моль С2Н5ОН.
2.3. Высшая теплота сгорания топлива QВ:
Qв 29715кДж/кг С2Н5ОН≈
≈29,72 МДж/кг С2Н5ОН.
2.4. Низшая энтальпия сгорания топлива рассчитывается по уравнению реакции:
СnНmOr + ×(O2+3,75 N2)
n CO2(г) + H2O(г)+ ×3,75 N2.
Для этилового спирта
C2H5OH(Ж) + 3 (O2 + 3,75N2)(г) 2 CO2(г) + 3H2O(г) + 11,25 N2.
Низшая энтальпия сгорания отличается от высшей на энтальпию конденсации водяного пара =−44,01 кДж/моль. Из уравнения реакции горения этилового спирта видно, что образуются три моля воды. Поэтому
−1366,91+3·44,01=
=−1234,88 кДж/моль.
2.5. Низшая теплота сгорания топлива QН:
QН 26845 кДж/кг С2Н5ОН ≈
≈ 26,85 МДж/кг С2Н5ОН.
2.6. Теоретически необходимое количество воздуха для полного сгорания 1 кг топлива:
= 8,9 кг воздуха/кг топлива.
2.7. Количество топливовоздушной смеси:
М1 = 1топлива + (О2 + 3,75N2)=1топлива+3(1+3,75)=15,25 моль.
2.8. Низшая теплота сгорания топливовоздушной смеси qн, она же калорийность стехиометрической смеси топлива с воздухом:
кДж/м3.
Таблица 6
Сравнительные характеристики (QН, , qн)
Этилового спирта и бензина
| Характеристики | Бензин | Этиловый спирт | |
| Справочные данные | Расчет | ||
| Низшая теплотворная способность, QН (МДж/кг) | 43,3 – 44,0 | 25,0 – 26,8 | 26,85 |
| Низшая теплота сгорания топливовоздушной смеси, qн (кДж/м3) | 3439 − 3910 | ||
| Стехиометрическая потребность воздуха в процессе сгорания, (кг воздуха / кг топлива) | 14,9 | 9,0 | 8,9 |
Выводы
Из приведенных данных (табл. 6) следует, что этиловый спирт и бензин имеют близкую по значению теплотворную способность стехиометрической смеси.
Для этилового спирта характерна меньшая теплотворная способность единицы массы топлива и требуется меньшее стехиометрическое количество воздуха, необходимое для сгорания спирта, что обусловлено меньшим содержанием углерода и большим содержанием кислорода в спирте.
Анализ физико-химических свойств этилового спирта и термодинамических расчетов в сравнении со свойствами бензина показывает возможность его использования в качестве топлива для двигателей с искровым зажиганием.
Проблемой, ограничивающей применение этилового спирта в качестве топлива, являются большие затраты энергии на производство спирта по сравнению с энергией, получаемой в процессе его сгорания.
Кроме того, коррозионная активность спиртов, а также их активность по отношению к ряду пластмасс требует пересмотра материалов топливной системы.
Этиловый спирт применяется в настоящее время для питания автомобилей в виде смеси (90% бензина + 10% С2Н5ОН – газойль).
ПРИЛОЖЕНИЕ
Таблица 1
Варианты заданий для выполнения курсовой работы
| № варианта | Вещество, агрегатное состояние | № варианта | Вещество, агрегатное состояние |
| С2Н2 (г) (ацетилен) | н-С6Н14(ж) (н-гексан) | ||
| С2Н4(г) (этилен) | н-С7Н16(ж) (н-гептан) | ||
| С2Н6(г) (этан) | н-С8Н18 (ж) (н-октан) | ||
| С3Н4 (г) (пропадиен) | н-С9Н20 (ж) (н-нонан) | ||
| С3Н6(г) (пропилен) | н-С10Н22(ж) (н-декан) | ||
| С3Н8(г) (пропан) | СН3ОН(ж) (метиловый спирт) | ||
| С3Н6(г) (циклопропан) | С3Н5ОН (ж) (аллиловый спирт) | ||
| н-С4Н8(г) (н-бутилен) | С3Н7ОН (ж) (н-пропиловый спирт) | ||
| изо-С4Н8(г) (изобутилен) | С3Н7ОН (ж) (изопропиловый спирт) | ||
| н-С4Н10(г) (н-бутан) | С4Н8О2 (ж) (этилацетат) | ||
| изо-С4Н10(г) (изобутан) | С4Н9ОН (ж) (н-бутиловый спирт) | ||
| С5Н10(ж) (циклопентан) | С4Н9ОН (ж) (изобутиловый спирт) | ||
| н-С5Н12(г) (н-пентан) | С4Н10О (ж) (диэтиловый эфир) | ||
| изо-С5Н12(г) (изопентан) | С6Н5СН2ОН (ж) (бензиловый спирт) | ||
| С6Н10(ж) (циклогексен) | С6Н11ОН (ж) (циклогексанол) | ||
| С6Н12(ж) (циклогексан) | С8Н17ОН(ж) (октиловый спирт) |
Таблица 2
Значения стандартных энтальпий сгорания
| Вещество | Агрегатное состояние | Но298,сгор., кДж/моль |
| Углеводороды | ||
| СН4 (метан) | газ | -890,31 |
| С2Н2 (ацетилен) | газ | -1299,63 |
| С2Н4 (этилен) | газ | -1410,97 |
| С2Н6 (этан) | газ | -1559,88 |
| С3Н4 (пропадиен) | газ | -1946,00 |
| С3Н6 (пропилен) | газ | -2051,00 |
| С3Н8 (пропан) | газ | -2220,03 |
| С3Н6 (циклопропан) | газ | -2078,60 |
| н-С4Н8 (н-бутилен) | газ | -2717,30 |
| изо-С4Н8 (изобутилен) | газ | -2700,50 |
| н-С4Н10 (н-бутан) | газ | -2878,83 |
| изо-С4Н10 (изобутан) | газ | -2871,69 |
| С5Н10 (циклопентан) | жидкость | -3278,60 |
| н-С5Н12 (н-пентан) | газ | -3536,15 |
| изо-С5Н12 (изопентан) | газ | -3528,11 |
| С6Н10 (циклогексен) | жидкость | -3731,70 |
| С6Н12 (циклогексан) | жидкость | -3919,91 |
| н-С6Н14 (н-гексан) | жидкость | -4163,12 |
| н-С7Н16 (н-гептан) | жидкость | -4811,12 |
| н-С8Н18 (н-октан) | жидкость | -5450,50 |
| н-С9Н20 (н-нонан) | жидкость | -6124,50 |
| н-С10Н22 (н-декан) | жидкость | -6737,10 |
| Кислородосодержащие соединения | ||
| СН3ОН (метиловый спирт) | жидкость | -715,00 |
| С2Н5ОН (этиловый спирт) | жидкость | -1366,91 |
| С3Н5ОН (аллиловый спирт) | жидкость | -1851,00 |
| С3Н7ОН (н-пропиловый спирт) | жидкость | -2010,40 |
| С3Н7ОН (изопропиловый спирт) | жидкость | -2003,80 |
| С4Н8О2 (этилацетат) | жидкость | -2254,21 |
| С4Н9ОН (н-бутиловый спирт) | жидкость | -2671,90 |
| С4Н9ОН (изобутиловый спирт) | жидкость | -2633,00 |
| С4Н10О (диэтиловый эфир) | жидкость | -2730,90 |
| С6Н5СН2ОН (бензиловый спирт) | жидкость | -3741,70 |
| С6Н11ОН (циклогексанол) | жидкость | -3726,70 |
| С8Н17ОН (октиловый спирт) | жидкость | -5280,20 |
ОГЛАВЛЕНИЕ
| 1. Введение | |
| 2. Методика расчета термодинамических характеристик | |
| 3. Методика выполнения курсовой работы(примеры) ПРИЛОЖЕНИЕ | |
megaobuchalka.ru
