Химическая формула — Википедия
Материал из Википедии — свободной энциклопедии
Хими́ческая фо́рмула — условное обозначение химического состава и структуры соединений с помощью символов химических элементов, числовых и вспомогательных знаков (скобок, тире и т. п.). Химические формулы являются составной частью языка химии, на их основе составляются схемы и уравнения химических реакций, а также химическая классификация и номенклатура веществ[1]. Одним из первых начал использовать их русский химик А. А. Иовский.
Химическая формула может обозначать или отражать[1]:
Например, формула HNO3 обозначает:
- 1 молекулу азотной кислоты или 1 моль азотной кислоты;
- качественный состав: молекула азотной кислоты состоит из водорода, азота и кислорода;
- количественный состав: в состав молекулы азотной кислоты входят один атом водорода, один атом азота и три атома кислорода.
В настоящее время различают следующие виды химических формул:
- Простейшая формула. Может быть получена опытным путём через определение соотношения химических элементов в веществе с применением значений атомной массы элементов. Так, простейшая формула воды будет H2O, а простейшая формула бензола CH (в отличие от C6H6 — истинной, см. далее). Атомы в формулах обозначаются знаками химических элементов, а относительное их количество — числами в формате нижних индексов.[2]
- Истинная формула. Молекулярная формула[3] — может быть получена, если известна молекулярная масса[3] вещества. Истинная формула воды Н2О, что совпадает с простейшей. Истинная формула бензола С6Н6, что отличается от простейшей. Истинные формулы также называют брутто-формулами. Они отражают состав, но не структуру молекул вещества. Истинная формула показывает точное количество атомов каждого элемента в одной молекуле. Этому количеству отвечает [нижний] индекс — маленькая цифра после символа соответствующего элемента. Если индекс равен 1, то есть в молекуле присутствует только один атом данного элемента, то такой индекс не указывают.
- Рациональная формула. В рациональных формулах выделяются группы атомов, характерные для классов химических соединений. Например, для спиртов выделяется группа -ОН. При записи рациональной формулы такие группы атомов заключаются в круглые скобки (ОН). Количество повторяющихся групп обозначаются числами в формате нижних индексов, которые ставятся сразу за закрывающей скобкой. Квадратные скобки применяются для отражения структуры комплексных соединений. Например, К4[Co(CN)6][4] — гексацианокобальтат калия. Рациональные формулы часто встречаются в полуразвернутом виде, когда часть одинаковых атомов показывается по отдельности для лучшего отражения строения молекулы вещества.
- Формула Маркуша представляют собой формулу, в которой выделяется активное ядро и некоторое количество вариантов заместителей, объединяемых в группу альтернативных структур. Она является удобным способом обозначения химических структур в обобщенном виде. Формула относится к описанию целого класса веществ. Использование «широких» формул Маркуша в химических патентах приводит к массе проблем и дискуссий.
- Эмпирическая формула. Разные авторы могут использовать этот термин для обозначения простейшей[5], истинной или рациональной[6] формулы.
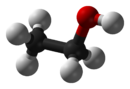
- Структурная формула. В графическом виде показывает взаимное расположение атомов в молекуле. Химические связи между атомами обозначаются линиями (чёрточками). Различают двумерные (2D) и трёхмерные (3D) формулы. Двумерные представляют собой отражение структуры вещества на плоскости (также скелетная формула — попытки приблизить 3D-структуру на 2D-плоскости). Трёхмерные [пространственные модели] позволяют наиболее близко к теоретическим моделям строения вещества представлять его состав, и, зачастую (но не всегда), более полное (истинное) взаимное расположение атомов, угол связи и расстояния между атомами.
Например, для этанола:
- Простейшая формула: С2Н6О
- Истинная, эмпирическая, или брутто-формула: С2Н6О
- Рациональная формула: С2Н5ОН
- Рациональная формула в полуразвернутом виде: СН3СН2ОН
- Структурная формула (2D):
Н Н
│ │
Н—С—С—О—Н
│ │
Н Н
- Структурная формула (3D):
- Вариант 1:

- Вариант 2:

Простейшей формуле С2Н6О в равной мере может соответствовать и диметиловый эфир (рациональная формула; структурная изомерия): СН3—О—СН3.
Существуют и другие способы записи химических формул. Новые способы появились в конце 1980-х с развитием персональной компьютерной техники (SMILES, WLN, ROSDAL, SLN и др.). В персональных компьютерах для работы с химическими формулами также используются специальные программные средства, называемые молекулярными редакторами.
- ↑ 1 2 Основные понятия химии
- ↑ Различают эмпирическую и истинную формулы. Эмпирическая формула выражает простейшую формулу вещества (химического соединения), которую устанавливают путём элементного анализа. Так, анализ показывает, что простейшая, или эмпирическая, формула некоторого соединения соответствует CH. Истинная формула показывает, какое количество таких простейших групп CH содержится в молекуле. Представим истинную формулу в виде (CH)x, тогда при значении x = 2 имеем ацетилен C2H2, при x= 6 — бензол C6H6.
- ↑ 1 2 Строго говоря, нельзя употреблять термины «молекулярная формула» и «молекулярная масса» соли, поскольку в солях нет молекул, а имеются только упорядоченные решётки, состоящие из ионов. Ни один из ионов натрия [катион] в структуре хлорида натрия не «принадлежит» какому-либо конкретному хлорид-иону [аниону]. Правильно говорить о химической формуле соли & соответствующей ей формульной массе. Поскольку химическая формула (истинная) хлорида натрия — NaCl, формульная масса хлорида натрия определяется как сумма атомных масс одного атома натрия и одного атома хлора:
1 атом натрия: 22,990 а. е. м.
1 атом хлора: 35,453 а. е. м.
Итого: 58,443 а. е. м.
Принято называть эту величину «молекулярной массой» хлорида натрия, и не возникает никаких недоразумений, если ясно отдавать себе отчёт, какую структуру имеет соль. Моль хлорида натрия имеет массу 58,443 г. В нём содержится 6,022·1023 ионов натрия и 6,022·1023 хлорид-ионов. Хотя они и не объединены попарно в молекулы, соотношение между числом тех и других ионов точно 1 : 1. - ↑ Формулы соединений ионного типа [и/или в предположении что они ионны — полярные ковалентные (промежуточные ионно-ковалентные)] выражают лишь простейшее соотношение между ионами (катионами и анионами). Так, кристалл поваренной соли NaCl состоит из ионов Na+ и Cl−, находящихся в соотношении 1:1, что обеспечивает электронейтральность соединения в целом. Рассуждая аналогично, отмечаем, что кристаллы CaF2 состоят из Ca2+ и F− в соотношении 1:2. Таким же образом К4 [Co(CN)6] состоит из катионов К+ и [комплексных координационных] анионов Co(CN)64− в соотношении 4:1 (хотя данное соединение имеет более сложное координационно-комплексное кристаллическое строение). Аналогичным образом пирит FeS2 содержит катионы Fe2+ и анионы S22− в соотношении 1:1 (сульфид-анионов S2− оно не имеет; атомы серы в персульфид-анионе связаны относительно прочной ковалентной [неполярной ковалентной] связью).
В соединениях подобного типа нельзя обнаружить отдельные молекулы NaCl и CaF2, и поэтому эти формулы указывают лишь на соотношение катионов и анионов, из которых состоят эти вещества (хим. соединения). - ↑ М. А. Федоровская. Формула химическая // Химическая энциклопедия в 5 т.. — М.: Большая Российская Энциклопедия, 1998. — Т. 5. — С. 123. — 783 с.
- ↑ Справочник химика. — Л.: Химия, 1971. — Т. II. — С. 397. — 1168 с. — 20 000 экз.
| Химическая формула | Название соединения | Номер по классификатору CAS |
|---|---|---|
| D2O | оксид дейтерия | 7732-20-0 |
| Химическая формула | Название соединения | Номер по классификатору CAS |
| LaCl3 | Хлорид лантана (III) | 10099-58-8 |
| LaPO4 | Фосфат лантана (III) | 14913-14-5 |
| Li(AlSi2O6) | Кеатит | |
| LiBr | Бромид лития | 7550-35-8 |
| LiBrO3 | Бромат лития | |
| LiCN | Цианид лития | |
| LiC2H5O | Этилат лития | |
| LiF | фторид лития | 7789-24-4 |
| LiHSO4 | Гидросульфат лития | |
| LiIO3 | Иодат лития | |
| LiNO3 | Нитрат лития | |
| LiTaO3 | Танталат лития | |
| Li2CrO4 | Хромат лития | |
| Li2Cr2O7 | Дихромат лития | |
| Li2MoO4 | Ортомолибдат лития | 13568-40-6 |
| Li2NbO3 | Метаниобат лития | |
| Li2SO4 | Сульфат лития | 10377-48-7 |
| Li2SeO3 | Селенит лития | |
| Li2SeO4 | Селенат лития | |
| Li2SiO3 | Метасиликат лития | 10102-24-6 |
| Li2SiO4 | Ортосиликат лития | |
| Li2TeO3 | Теллурит лития | |
| Li2TeO4 | Теллурат лития | |
| Li2TiO3 | Метатитанат лития | 12031-82-2 |
| Li2WO4 | Ортовольфрамат лития | 13568-45-1 |
| Li2ZrO3 | Метацирконат лития | |
| Химическая формула | Название соединения | Номер по классификатору CAS |
| PH3 | phosphine | 7803-51-2 |
| POCl3 | phosphoryl chloride | 10025-87-3 |
| PO43− | phosphate ion | |
| P2I4 | phosphorus(II) iodide | |
| P2O74− | pyrophosphate ion | |
| P2S3 | phosphorus(III) sulfide | |
| P2Se3 | phosphorus(III) selenide | |
| P2Se5 | phosphorus(V) selenide | |
| P2Te3 | phosphorus(III) telluride | |
| P3N5 | phosphorus(V) nitride | 12136-91-3 |
| P4O10 | tetraphosphorus decaoxide | 16752-60-6 |
| Pb(CH3COO)2·3H2O | ацетат свинца — тригидрат | |
| PbCO3 | lead carbonate cerussite | |
| Pb(C2H5)4 | tetraethyllead | |
| PbC2O4 | lead oxalate | |
| PbCrO4 | lead chromate | |
| PbF2 | lead fluoride | 7783-46-2 |
| Pb(IO3)2 | lead iodate | |
| PbI2 | lead(II) iodide | 10101-63-0 |
| Pb(NO3)2 | lead(II) nitrate lead dinitrate plumbous nitrate | |
| Pb(N3)2 | lead azide | |
| PbO | lead(II) oxide litharge | 1317-36-8 |
| Pb(OH)2 | plumbous hydroxide | |
| Pb(OH)4 | plumbic hydroxide plumbic acid | |
| Pb(OH)62− | plumbate ion | |
| PbO2 | lead(IV) oxide lead dioxide | 1309-60-0 |
| PbS | сульфид свинца галенит | 1314-87-0 |
| PbSO4 | сульфат свинца(II) | 7446-14-2 |
| Pb3(SbO4)2 | lead antimonate | |
| PtBr2 | platinum(II) bromide | |
| PtBr4 | platinum(IV) bromide | |
| PtCl2 | platinum(II) chloride | |
| PtCl4 | platinum(IV) chloride | |
| PtI2 | platinum(II) iodide | |
| PtI4 | platinum(IV) iodide | |
| [Pt(NH2CH2CH2NH2)3]Br4 | tris(ethylenediamine)platinum(IV) bromide | |
| [Pt(NH3)2(H2O)2Cl2]Br2 | diamminediaquadichloroplatinum(VI) bromide | |
| PtO2 | platinum(IV) oxide | 50417-46-4 |
| PtS2 | platinum(IV) sulfide | |
| Химическая формула | Название соединения | Номер по классификатору CAS |
| RbAl(SO4)2·12H2O | rubidium aluminum sulfate — dodecahydrate | |
| RbBr | rubidium bromide | 7789-39-1 |
| RbC2H3O2 | rubidium acetate | |
| RbCl | rubidium chloride | 7791-11-9 |
| RbClO4 | rubidium perchlorate | |
| RbF | rubidium fluoride | 13446-74-7 |
| RbNO3 | rubidium nitrate | 13126-12-0 |
| RbO2 | rubidium superoxide | |
| Rb2C2O4 | rubidium oxalate | |
| Rb2CrO4 | rubidium chromate | |
| Rb2PO4 | rubidium orthophosphate | |
| Rb2SeO3 | rubidium selenite | |
| Rb2SeO4 | rubidium selenate | |
| Rb3C6H5O7·H2O | rubidium citrate — monohydrate | |
| Химическая формула | Название соединения | Номер по классификатору CAS |
| SCN− | thiocyanate | |
| SF4 | sulfur tetrafluoride | |
| SF6 | sulfur hexafluoride | 2551-62-4 |
| SOF2 | thionyl difluoride | 7783-42-8 |
| SO2 | sulfur dioxide | 7446-09-5 |
| SO2Cl2 | sulfuryl chloride | 7791-25-5 |
| SO2F2 | sulfuryl difluoride | 2699-79-8 |
| SO2OOH− | peroxymonosulfurous acid (aqueous) | |
| SO3 | sulfur trioxide | 7446-11-9 |
| SO32− | sulfite ion | |
| SO42− | sulfate ion | |
| S2Br2 | sulfur(II) bromide | 71677-14-0 |
| S2O32− | thiosulfate ion | |
| S2O72− | disulfate ion | |
| SbBr3 | antimony(III) bromide | 7789-61-9 |
| SbCl3 | antimony(III) chloride | 10025-91-9 |
| SbCl5 | antimony(V) chloride | 7647-18-9 |
| SbI3 | antimony(III) iodide | 7790-44-5 |
| SbPO4 | antimony(III) phosphate | |
| Sb2OS2 | antimony oxysulfide kermesite | |
| Sb2O3 | antimony(III) oxide | 1309-64-4 |
| Sb2O5 | antimony(V) oxide | |
| Sb2S3 | antimony(III) sulfide | 1345-04-6 |
| Sb2Se3 | antimony(III) selenide | 1315-05-5 |
| Sb2Se5 | antimony(V) selenide | |
| Sb2Te3 | antimony(III) telluride | |
| Sc2O3 | scandium oxide scandia | |
| SeBr4 | selenium(IV) bromide | |
| SeCl | selenium(I) chloride | |
| SeCl4 | selenium(IV) chloride | 10026-03-6 |
| SeOCl2 | selenium(IV) oxychloride | 7791-23-3 |
| SeOF2 | selenyl difluoride | |
| SeO2 | selenium(IV) oxide | 7446-08-4 |
| SeO42− | selenate ion | |
| SeTe | selenium(IV) telluride | 12067-42-4 |
| SiBr4 | silicon(IV) bromide | 7789-66-4 |
| SiC | карбид кремния | 409-21-2 |
| SiCl4 | silicon(IV) chloride | 10026-04-7 |
| SiH4 | силан | 7803-62-5 |
| SiI4 | silicon(IV) iodide | 13465-84-4 |
| SiO2 | диоксид кремния silica кварц | 7631-86-9 |
| SiO44− | silicate ion | |
| Si2O76− | disilicate ion | |
| Si3N4 | silicon nitride | 12033-89-5 |
| Si6O1812− | cyclosilicate ion | |
| SnBrCl3 | tin(IV) bromotrichloride | |
| SnBr2 | tin(II) bromide | 10031-24-0 |
| SnBr2Cl2 | tin(IV) dibromodichloride | |
| SnBr3Cl | tin(IV) tribromochloride | 14779-73-8 |
| SnBr4 | tin(IV) bromide | 7789-67-5 |
| SnCl2 | tin(II) chloride | 7772-99-8 |
| SnCl2I2 | tin(IV) dichlorodiiodide | |
| SnCl4 | tin(IV) chloride | 7646-78-8 |
| Sn(CrO4)2 | tin(IV) chromate | |
| SnI4 | tin(IV) iodide | 7790-47-8 |
| SnO2 | tin(IV) oxide | 18282-10-5 |
| SnO32− | stannate ion | |
| SnS | tin(II) sulfide | 1314-95-0 |
| SnS2 | tin(IV) sulfide | |
| Sn(SO4)2·2H2O | tin(IV) sulfate — dihydrate | |
| SnSe | tin(II) selenide | 1315-06-6 |
| SnSe2 | tin(IV) selenide | |
| SnTe | tin(II) telluride | 12040-02-7 |
| SnTe4 | tin(IV) telluride | |
| Sn(VO3)2 | tin(II) metavanadate | |
| Sn3Sb4 | tin(IV) antimonide | |
| SrBr2 | strontium bromide | 10476-81-0 |
| SrBr2·6H2O | strontium bromide — hexahydrate | |
| SrCO3 | strontium carbonate | |
| SrC2O4 | strontium oxalate | |
| SrF2 | strontium fluoride | 7783-48-4 |
| SrI2 | strontium iodide | 10476-86-5 |
| SrI2·6H2O | strontium iodide — hexahydrate | |
| Sr(MnO4)2 | strontium permanganate | |
| SrMoO4 | strontium orthomolybdate | 13470-04-7 |
| Sr(NbO3)2 | strontium metaniobate | |
| SrO | strontium oxide | 1314-11-0 |
| SrSeO3 | strontium selenite | |
| SrSeO4 | strontium selenate | |
| SrTeO3 | strontium tellurite | |
| SrTeO4 | strontium tellurate | |
| SrTiO3 | титанат стронция | |
| Химическая формула | Название соединения | Номер по классификатору CAS |
| T2O | оксид трития tritiated water | 14940-65-9 |
| TaBr3 | бромид тантала (III) | |
| TaBr5 | бромид тантала (V) | |
| TaCl5 | Хлорид тантала(V) | 7721-01-9 |
| TaI5 | Иодид тантана(V) | |
| TaO3− | tantalate ion | |
| TcO4− | pertechnetate ion | |
| TeBr2 | tellurium(II) bromide | |
| TeBr4 | tellurium(IV) bromide | |
| TeCl2 | tellurium(II) chloride | |
| TeCl4 | tellurium(IV) chloride | 10026-07-0 |
| TeI2 | tellurium(II) iodide | |
| TeI4 | tellurium(IV) iodide | |
| TeO2 | tellurium(IV) oxide | 7446-07-3 |
| TeO4− | tellurate ion | |
| TeY | yttrium telluride | 12187-04-1 |
| Th(CO3)2 | thorium carbonate | 19024-62-5 |
| Th(NO3)4 | thorium nitrate | 13823-29-5 |
| TiBr4 | titanium(IV) bromide | 7789-68-6 |
| TiCl2I2 | titanium(IV) dichlorodiiodide | |
| TiCl3I | titanium(IV) trichloroiodide | |
| TiCl4 | titanium tetrachloride | 7550-45-0 |
| TiO2 | оксид титана (IV) рутил | 1317-70-0 |
| TiO32− | titanate ion | |
| TlBr | thallium(I) bromide | 7789-40-4 |
| TlBr3 | thallium(III) bromide | |
| Tl(CHO2) | thallium(I) formate | |
| TlC2H3O2 | thallium(I) acetate | 563-68-8 |
| Tl(C3H3O4) | thallium(I) malonate | |
| TlCl | thallium(I) chloride | 7791-12-0 |
| TlCl3 | thallium(III) chloride | |
| TlF | thallium(I) fluoride | 7789-27-7 |
| TlI | thallium(I) iodide | 7790-30-9 |
| TlIO3 | thallium(I) iodate | |
| TlI3 | thallium(III) iodide | |
| TiI4 | titanium(IV) iodide | 7720-83-4 |
| TiO(NO3)2 · xH2O | titanium(IV) oxynitrate — hydrate | |
| TlNO3 | thallium(I) nitrate | 10102-45-1 |
| TlOH | thallium(I) hydroxide | |
| TlPF6 | thallium(I) hexafluorophosphate | 60969-19-9 |
| TlSCN | thallium thiocyanate | |
| Tl2MoO4 | thallium(I) orthomolybdate | |
| Tl2SeO3 | thallium(I) selenite | |
| Tl2TeO3 | thallium(I) tellurite | |
| Tl2WO4 | thallium(I) orthotungstate | |
| Tl3As | thallium(I) arsenide | |
| Химическая формула | Название соединения | Номер по классификатору CAS |
| Zn(AlO2)2 | алюминат цинка | |
| Zn(AsO2)2 | арсенит цинка | 10326-24-6 |
| ZnBr2 | бромид цинка | 7699-45-8 |
| Zn(CN)2 | цианид цинка | 557-21-1 |
| ZnCO3 | карбонат цинка | 3486-35-9 |
| Zn(C8H15O2)2 | каприлат цинка | 557-09-5 |
| Zn(ClO3)2 | хлорат цинка | 10361-95-2 |
| ZnCl2 | хлорид цинка | 7646-85-7 |
| ZnCr2O4 | хромит цинка | 12018-19-8 |
| ZnF2 | фторид цинка | 7783-49-5 |
| Zn(IO3)2 | иодат цинка | 7790-37-6 |
| ZnI2 | иодид цинка | 10139-47-6 |
| ZnMoO4 | ортомолибдат цинка | |
| Zn(NO2)2 | нитрит цинка | 10102-02-0 |
| Zn(NO3)2 | нитрат цинка | 7779-88-6 |
| Zn(NbO3)2 | метаниобат цинка | |
| ZnO | оксид цинка | 1314-13-2 |
| ZnO2 | пероксид цинка | 1314-22-3 |
| Zn(OH)2 | гидроксид цинка | 20427-58-1 |
| Zn(OH)42− | zincate ion | |
| ZnS | сульфид цинка сфалерит | 1314-98-3 |
| Zn(SCN)2 | тиоцианат цинка | 557-42-6 |
| ZnSO4 | сульфат цинка | 7733-02-0 |
| ZnSb | антимонид цинка | 12039-35-9 |
| ZnSe | селенид цинка | 1315-09-9 |
| ZnSeO3 | селенит цинка | |
| ZnSnO3 | станнат цинка | |
| Zn(TaO3)2 | метатанталат цинка | |
| ZnTe | теллурид цинка | 1315-11-3 |
| ZnTeO3 | теллурит цинка | |
| ZnTeO4 | теллурат цинка | |
| ZnTiO3 | метатитанат цинка | |
| Zn(VO3)2 | метаванадат цинка | |
| ZnWO4 | zinc orthotungstate | |
| ZnZrO3 | метацирконат цинка | |
| Zn2P2O7 | пирофосфат цинка | 7446-26-6 |
| Zn2SiO4 | ортосиликат цинка | 13597-65-4 |
| Zn3(AsO4)2 | арсенат цинка | 13464-44-3 |
| Zn3As2 | арсенид цинка | |
| Zn3N2 | нитрид цинка | 1313-49-1 |
| Zn3P2 | фосфид цинка | 1314-84-7 |
| Zn3(PO4)2 | фосфат цинка | 7779-90-0 |
| Zn3Sb2 | антимонид цинка | |
| ZrB2 | борид циркония | 12045-64-6 |
| ZrBr4 | бромид циркония | 13777-25-8 |
| ZrC | карбид циркония | 12020-14-3 |
| ZrCl4 | тетрахлорид циркония | 10026-11-6 |
| ZrF4 | фторид циркония | 7783-64-4 |
| ZrI4 | иодид циркония | 13986-26-0 |
| ZrN | нитрид циркония | 25658-42-8 |
| Zr(OH)4 | гидроксид циркония | 14475-63-9 |
| ZrO2 | диоксид циркония бадделеит | 1314-23-4 |
| ZrO32− | цирконат-ион | |
| ZrP2 | фосфид циркония | 12037-80-8 |
| ZrS2 | сульфид циркония | 12039-15-5 |
| ZrSi2 | силицид циркония (ди)силицид циркония[1] | 12039-90-6 |
| ZrSiO4 | ортосиликат циркония циркон | 10101-52-7 |
| Zr3(PO4)4 | фосфат циркония |
Гидроксид-ион — Википедия
Материал из Википедии — свободной энциклопедии
Гидроксид-ион (гидроксид-анион, гидроксильный ион) — отрицательно заряженный ион гидроксида OH−.
Гидроксид-ион изолированно существует в газовой фазе, находится в кристаллической решётке гидроксидов и основных солей, образуется в водных растворах в результате электролитической диссоциации воды или/и растворённых гидроксидов.
Наличие в водном растворе иона OH− в концентрациях, превышающих 10−7моль/литр приводит к щелочной реакции раствора.
В реакциях комплексообразования гидроксид-ион может выступать в роли лиганда[1].
Рыхлая слоистая кристаллическая структура гидроксидов является следствием высокой поляризуемости и большого ионного радиуса гидроксид-аниона.
В газовой фазе имеет место равновесная реакция, характеризующая термическую устойчивость гидроксид-иона
- OH−→OH+e−{\displaystyle {\mathsf {OH^{-}\rightarrow OH+e^{-}}}}
Зависимость константы равновесия (Kp) от абсолютной температуры (T)[2]:
| Т,к | 1000 | 2000 | 3000 | 4000 | 5000 | 6000 |
|---|---|---|---|---|---|---|
| Кр | 1,66 · 10−7 | 2,34 · 10−2 | 1,94 | 2,23 · 10 | 1,11 · 102 | 3,56 · 102 |
Электролитическая диссоциация оснований[править | править код]
При электролитической диссоциации оснований образуются катионы металла и общие для всех оснований ионы гидроксида:
- NaOH⇄Na++OH−{\displaystyle {\mathsf {NaOH\rightleftarrows Na^{+}+OH^{-}}}}
- Ba(OH)2⇄Ba2++2OH−{\displaystyle {\mathsf {Ba(OH)_{2}\rightleftarrows Ba^{2+}+2OH^{-}}}}
Таким образом, основания можно определить как химические соединения, дающие в водном растворе гидроксид-ионы.
Электролитическая диссоциация оснований характеризуется константой диссоциации в водных растворах КB[3]:
| Основание | LiOH | NaOH | Ca(OH)2 | Sr(OH)2 | Ba(OH)2 | NH4OH |
|---|---|---|---|---|---|---|
| КB, при 25 °C | 6,75 · 10−1 | 5,9 | 4,3 · 10−2 | 1,5 · 10−1 | 2,3 · 10−1 | 1,79 · 10−5 |
Основной реакцией, в которой принимает участие гидроксид-ион, является реакция нейтрализации кислот и оснований:
- NaOH+HCl→NaCl+h3O{\displaystyle {\mathsf {NaOH+HCl\rightarrow NaCl+H_{2}O}}}
или в ионном виде:
- OH−+H+→h3O{\displaystyle {\mathsf {OH^{-}+H^{+}\rightarrow H_{2}O}}}
Последнее выражение представляет собой общее уравнение реакций нейтрализации и показывает, что во всех случаях, когда ионы H+ встречаются с ионами гидроксида OH—, они соединяются в почти недиссоциированные молекулы воды. В реакции гидроксид-ион проявляет свойства нуклеофила — электроизбыточного химического реагента, способного взаимодействовать с электрофилами (электронодефицитными соединениями) по донорно-акцепторному механизму, приводящему к образованию ковалентной химической связи.
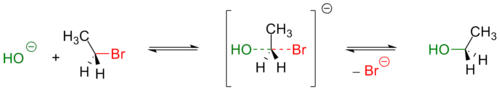
Гидроксид-ион принимает участие в реакциях бимолекулярного нуклеофильного замещения. Например, атом кислорода гидроксид-иона донирует пару электронов на связывание с атомом углерода в молекуле бромэтана:
Типичные реакции нуклеофильного замещения:
- Образование спиртов из галогенуглеводородов:
- C2H5Br+OH−→C2H5OH+Br−{\displaystyle {\mathsf {C_{2}H_{5}Br+OH^{-}\rightarrow C_{2}H_{5}OH+Br^{-}}}}
- Образование кетонов:
- Ch4CBr2Ch4+2OH−→(Ch4)2O+2Br−+h3O{\displaystyle {\mathsf {CH_{3}CBr_{2}CH_{3}+2OH^{-}\rightarrow (CH_{3})_{2}O+2Br^{-}+H_{2}O}}}
- Образование карбоновых кислот:
- Ch4CCl3+3OH−→Ch4COOH+3Cl−+h3O{\displaystyle {\mathsf {CH_{3}CCl_{3}+3OH^{-}\rightarrow CH_{3}COOH+3Cl^{-}+H_{2}O}}}
- Омыление сложных эфиров:
- Ch4COOC2H5+OH−→Ch4COO−+C2H5OH{\displaystyle {\mathsf {CH_{3}COOC_{2}H_{5}+OH^{-}\rightarrow CH_{3}COO^{-}+C_{2}H_{5}OH}}}
- ↑ Лидин Р.А., Андреева Л.Л., Молочко В.А. Константы неорганических веществ: справочник. — М: Дрофа, 2006. — С. 595-596.
- ↑ Справочник химика. — 2-е изд., перераб. и доп.. — М.-Л.: «Химия», 1964. — Т. 3. — С. 75. — 1008 с.
- ↑ Справочник химика. — 2-е изд., перераб. и доп.. — М.-Л.: «Химия», 1964. — Т. 3. — С. 81. — 1008 с.
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1 (Абл-Дар). — 623 с.
Гидроксид бария — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 18 октября 2018; проверки требуют 2 правки. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 18 октября 2018; проверки требуют 2 правки.Гидрокси́д ба́рия (е́дкий бари́т) — неорганическое соединение, проявляющее сильные основные свойства. Химическая формула — Ba(OH)2. Насыщенный водный раствор гидроксида бария называется баритовой водой.
Гидроксид бария при стандартных условиях представляет собой бесцветные кристаллы. Гигроскопичен. Не растворим в спирте, но растворим в воде. Образует кристаллогидраты с одной, двумя, семью и восемью молекулами воды. Гидроксид бария токсичен, ПДК составляет 0,5 мг/м³.
1. Взаимодействие металлического бария с водой:
Ba+2 h3O⟶ Ba(OH)2+ h3↑{\displaystyle {\mathsf {Ba+2\ H_{2}O\longrightarrow \ Ba(OH)_{2}+\ H_{2}\uparrow }}}
2. Взаимодействие оксида бария с водой:
BaO+ h3O⟶ Ba(OH)2{\displaystyle {\mathsf {BaO+\ H_{2}O\longrightarrow \ Ba(OH)_{2}}}}
3. Взаимодействие сульфида бария с горячей водой:
BaS+2 h3O⟶ Ba(OH)2+ h3S↑{\displaystyle {\mathsf {BaS+2\ H_{2}O\longrightarrow \ Ba(OH)_{2}+\ H_{2}S\uparrow }}}
1. Взаимодействие с кислотами с образованием соли и воды (реакция нейтрализации):
Ba(OH)2+2 HBr⟶ BaBr2+2 h3O{\displaystyle {\mathsf {Ba(OH)_{2}+2\ HBr\longrightarrow \ BaBr_{2}+2\ H_{2}O}}}
Ba(OH)2+ h3SO4⟶ BaSO4↓+2 h3O{\displaystyle {\mathsf {Ba(OH)_{2}+\ H_{2}SO_{4}\longrightarrow \ BaSO_{4}\downarrow +2\ H_{2}O}}}
2. Взаимодействие с кислотными оксидами с образованием соли и воды:
Ba(OH)2+ CO2⟶ BaCO3↓+ h3O{\displaystyle {\mathsf {Ba(OH)_{2}+\ CO_{2}\longrightarrow \ BaCO_{3}\downarrow +\ H_{2}O}}}
Ba(OH)2+ SO3⟶ BaSO4↓+ h3O{\displaystyle {\mathsf {Ba(OH)_{2}+\ SO_{3}\longrightarrow \ BaSO_{4}\downarrow +\ H_{2}O}}}
3. Взаимодействие с амфотерными оксидами
4. Взаимодействие с солями
Применяют гидроксид бария в виде баритовой воды как реактив на SO42− и CO32− (сульфат- и карбонат-ионы), для очистки растительных масел и животных жиров, как компонент смазок, для удаления SO42− (сульфат-ионов) из промышленных растворов, получения солей бария, а также гидроксидов рубидия и цезия из их сульфатов и карбонатов.
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1 (Абл-Дар). — 623 с.
Гидропероксильный радикал — Википедия
Материал из Википедии — свободной энциклопедии
Гидропероксильный радикал или пероксильный радикал — это протонированная форма супероксида с формулой HO2•.
Гидропероксильный радикал образуется в результате переноса атома водорода на молекулу кислорода, путём взаимодействия атома кислорода с гидроксильным радикалом (HO•) или протона с супероксид анионом[2].
В водном растворе супероксид анинон O2− и гидропероксильный радикал находятся в равновесии:
- O2− + H2O
 HO2 + OH−
HO2 + OH−
Константа равновесия этого процесса pKa = 4.88[3], из чего можно сделать вывод, что 0,3 % супероксида в цитозоле находится в протонированной форме.
В отличие от O2−, который является сильным восстановителем, HO2• в ходе многих биологически важных реакций может вести себя как окислитель, отбирая атомы водорода от токоферола и полиненасышенных жирных кислот липидной мембраны. По этой причине он является одним из основных инициаторов перекисного окисления липидов.
Поскольку диэлектрическая постоянная сильно влияет на pKa, а диэлектрическая проницаемость воздуха весьма мала, образующийся (фотохимически) в атмосфере супероксид практически полностью существует в форме HO2•. Поскольку HO2• весьма реакционноспособен, он действует как атмосферное «моющее средство», разлагая некоторые органические загрязнители. По этой причине химия HO2 имеет геохимическое значение.
Гидропероксильный радикал разрушает озоновый слой стратосферы; он образуется в результате окисления углеводородов в тропосфере[2].
Гидроксиды — Википедия
Материал из Википедии — свободной энциклопедии
Гидрокси́ды (гидроо́киси, водокиси) — неорганические соединения, содержащие в составе гидроксильную группу −OH{\displaystyle {\ce {-OH}}}. Известны гидроксиды почти всех химических элементов; некоторые из них встречаются в природе в виде минералов. Гидроксиды щелочных и щёлочноземельных металлов, а также аммония являются растворимыми и называются щелочами.
В зависимости от того, является ли соответствующий оксид основным, кислотным или амфотерным, соответственно различают:
- основные гидроксиды (основания) — только гидроксиды металлов со степенью окисления +1, +2, проявляющие основные свойства (например, гидроксид кальция Ca(OH)2{\displaystyle {\ce {Ca(OH)2}}}, гидроксид калия KOH{\displaystyle {{\ce {KOH}}}}, гидроксид натрия NaOH{\displaystyle {\ce {NaOH}}} и др.) При реакциях и диссоциации отщепляется группа −OH{\displaystyle {\ce {-OH}}}.
- кислотные гидроксиды (кислородсодержащие кислоты) — гидроксиды неметаллов и металлов со степенью окисления +5, +6, проявляющие кислотные свойства (например, азотная кислота HNO3{\displaystyle {\ce {HNO3}}}, серная кислота h3SO4{\displaystyle {\ce {h3SO4}}}, сернистая кислота h3SO3{\displaystyle {\ce {h3SO3}}} и др.) При реакциях и диссоциации отщепляется протон.
- амфотерные гидроксиды, гидроксиды металлов со степенью окисления +3, +4 и нескольких металлов со степенью окисления +2, которые проявляют амфотерные свойства. Амфотерные гидроксиды проявляют в зависимости от условий либо основные, либо кислотные свойства (например, гидроксид алюминия Al(OH)3{\displaystyle {\ce {Al(OH)3}}}, гидроксид цинка Zn(OH)2{\displaystyle {\ce {Zn(OH)2}}}).
Термин «гидроксиды» часто применяют только по отношению к основным и амфотерным гидроксидам. Также иногда называют гидроксидом воду.
Основные гидроксиды[править | править код]
Оксиды щелочных и некоторых щëлочноземельных металлов взаимодействуют с водой, образуя щëлочи:
- Na2O+h3O⟶2NaOH{\displaystyle {\ce {Na2O + h3O -> 2NaOH}}},
- CaO+h3O⟶Ca(OH)2{\displaystyle {\ce {CaO + h3O -> Ca(OH)2}}}.
Нерастворимые основания при нагревании, как правило, разлагаются на оксид и воду, например:
- 2Fe(OH)3⟶Fe2O3+3h3O{\displaystyle {\ce {2Fe(OH)3 -> Fe2O3 + 3h3O}}},
- Cu(OH)2⟶CuO+h3O{\displaystyle {\ce {Cu(OH)2 -> CuO + h3O}}}.
Гидроксид магния — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 3 декабря 2017; проверки требуют 5 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 3 декабря 2017; проверки требуют 5 правок.Гидрокси́д ма́гния — неорганическое вещество, осно́вный гидроксид металла магния, имеет формулу Mg(OH)2{\displaystyle {\ce {Mg(OH)2}}}. Слабое малорастворимое основание.
При стандартных условиях гидроксид магния представляет собой аморфное вещество. При температуре выше 350 °C разлагается на оксид магния и воду. Поглощает углекислый газ и воду из воздуха с образованием основного карбоната магния. Гидроксид магния практически нерастворим в воде, но растворим в солях аммония. Является слабым основанием, даже ничтожная его часть, растворившаяся в воде, сообщает раствору слабощелочную реакцию и окрашивает индикаторы, например, фенолфталеин, в розовый цвет. Встречается в природе в виде минерала брусита.[2]
- В общем виде:
Mg2++2 OH−⟶Mg(OH)2↓{\displaystyle {\mathsf {Mg^{2+}+2\ OH^{-}\longrightarrow Mg(OH)_{2}\downarrow }}}
- Примеры:
MgCl2+2NaOH⟶Mg(OH)2↓+2NaCl{\displaystyle {\mathsf {MgCl_{2}+2NaOH\longrightarrow Mg(OH)_{2}\downarrow +2NaCl}}}
Mg(NO3)2+2KOH⟶Mg(OH)2↓+2KNO3{\displaystyle {\mathsf {Mg(NO_{3})_{2}+2KOH\longrightarrow Mg(OH)_{2}\downarrow +2KNO_{3}}}}
MgCl2+CaO⋅MgO+2h3O⟶2Mg(OH)2↓+CaCl2{\displaystyle {\mathsf {MgCl_{2}+CaO\cdot MgO+2H_{2}O\longrightarrow 2Mg(OH)_{2}\downarrow +CaCl_{2}}}}
Mg+2h3O⟶Mg(OH)2↓+h3↑{\displaystyle {\mathsf {Mg+2H_{2}O\longrightarrow Mg(OH)_{2}\downarrow +H_{2}\uparrow }}}
- Как и все слабые основания, гидроксид магния термически неустойчив. Разлагается при нагревании до 350 °C:
Mg(OH)2→ΔTMgO+h3O{\displaystyle {\mathsf {Mg(OH)_{2}{\xrightarrow {\Delta T}}MgO+H_{2}O}}}
Mg(OH)2+2HCl⟶MgCl2+2h3O{\displaystyle {\mathsf {Mg(OH)_{2}+2HCl\longrightarrow MgCl_{2}+2H_{2}O}}}
Mg(OH)2+h3SO4⟶MgSO4+2h3O{\displaystyle {\mathsf {Mg(OH)_{2}+H_{2}SO_{4}\longrightarrow MgSO_{4}+2H_{2}O}}}
Mg(OH)2+SO3⟶MgSO4+h3O{\displaystyle {\mathsf {Mg(OH)_{2}+SO_{3}\longrightarrow MgSO_{4}+H_{2}O}}}
Mg(OH)2+2NaOH⟶Na2[Mg(OH)4]{\displaystyle {\mathsf {Mg(OH)_{2}+2NaOH\longrightarrow Na_{2}[Mg(OH)_{4}]}}}
Mg(OH)2+Sr(OH)2⟶Sr[Mg(OH)4]{\displaystyle {\mathsf {Mg(OH)_{2}+Sr(OH)_{2}\longrightarrow Sr[Mg(OH)_{4}]}}}
Гидроксид магния применяется для связывания диоксида серы, как флокулянт для очистки сточных вод, в качестве огнезащитного средства в термопластических полимерах (полиолефины, ПВХ), как добавка в моющие средства, для получения оксида магния, рафинирования сахара, в качестве компонента зубных паст.
В медицине его применяют в качестве лекарства для нейтрализации кислоты в желудке, а также как очень сильное слабительное.
В Европейском союзе гидроксид магния зарегистрирован в качестве пищевой добавки E528.
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1990. — Т. 2 (Даф-Мед). — 671 с. — ISBN 5-82270-035-5.

 HO2 + OH−
HO2 + OH−